(2012?六合区一模)某校兴趣小组同学准备进行常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中,有一装溶液的试剂瓶未盖瓶塞且标签破损,于是决定对这瓶溶液进行实验探究:
【提出问题】这瓶溶液是什么溶液?
【提出猜想】这瓶溶液是:
猜想一:氯化钠溶液; 猜想二:氢氧化钠溶液; 猜想三:碳酸钠溶液.
【实验推断】
(1)小丽取样滴加无色酚酞溶液,溶液呈红色,得出结论:该溶液不可能是
氯化钠溶液
氯化钠溶液
溶液,理由是
氯化钠溶液呈中性,不能使酚酞溶液变红色
氯化钠溶液呈中性,不能使酚酞溶液变红色
.
(2)小刚另取样滴加稀盐酸有
气泡
气泡
产生,反应的化学方程式为
Na2CO3+2HCl=2NaCl+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
,小刚得出结论:该溶液是碳酸钠溶液.
(3)小青认为小刚的结论不完全正确,理由是
露置于空气中的NaOH溶液与空气中的CO2反应也生成碳酸钠
露置于空气中的NaOH溶液与空气中的CO2反应也生成碳酸钠
.
小组同学讨论后一致认为还需要进行如下实验:
【继续探究】为了完全除去溶液中的Na
2CO
3,另取样加入过量的CaCl
2溶液,观察到有
白色沉淀
白色沉淀
产生.静置后,取上层清液,滴入酚酞溶液,溶液呈红色.
【实验结论】这瓶溶液是
NaOH溶液(填变质的NaOH溶液也可)
NaOH溶液(填变质的NaOH溶液也可)
.
【探究启示】实验过程中取完药品后应立即盖好瓶塞.
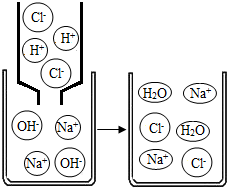
【拓展迁移】若该溶液与盐酸发生中和反应,恰好完全反应的微观过程如图所示,则反应后溶液中存在的阴、阳离子是
Cl-、Na+
Cl-、Na+
(填符号).





 备战中考寒假系列答案
备战中考寒假系列答案 (2012?六合区一模)如图中直线相连物质间在一定条件下可以发生反应.下表提供的四组物质符合图中要求的是( )
(2012?六合区一模)如图中直线相连物质间在一定条件下可以发生反应.下表提供的四组物质符合图中要求的是( )