
 A、B、C、D为四种不同类别的含有氧元素的化合物.物质之间相互反应如图所示.若A能使紫色石蕊溶液变为红色,B为烧碱,C能使无色酚酞溶液变为红色.请回答下列问题.
A、B、C、D为四种不同类别的含有氧元素的化合物.物质之间相互反应如图所示.若A能使紫色石蕊溶液变为红色,B为烧碱,C能使无色酚酞溶液变为红色.请回答下列问题.  2Fe+3CO2;(3)Na2CO3;制取烧碱.
2Fe+3CO2;(3)Na2CO3;制取烧碱.

科目:初中化学 来源: 题型:
 18、如图所示A、B、C、D为四种物质的溶解度曲线,请将正确答案填入空格内:
18、如图所示A、B、C、D为四种物质的溶解度曲线,请将正确答案填入空格内:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
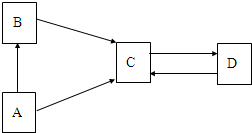 A、B、C、D为四种常见的物质,它们之间的转化关系如图所示,B、C、D中都含有同种非金属元素,A是一种单质,D是大理石的主要成分,它们的转化关系如图.请回答:
A、B、C、D为四种常见的物质,它们之间的转化关系如图所示,B、C、D中都含有同种非金属元素,A是一种单质,D是大理石的主要成分,它们的转化关系如图.请回答:
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com