
| A. | NaNO3、NaCl、KNO3、(NH4)2SO4 | B. | H2SO4、HCl、AgNO3、Na2SO4 | ||
| C. | KMnO4、CuCl2、Fe2(SO4)3、NaNO3 | D. | K2SO4、NaCl、K2CO3、NaOH |
分析 pH为13的水溶液显碱性,水溶液中含有大量的OH-.根据复分解反应发生的条件可知,若物质之间相互交换成分不能生成水、气体、沉淀,则能够在溶液中大量共存,且注意带色的两种,且据此进行分析判断即可.
解答 解:pH为13的水溶液显碱性,水溶液中含有大量的OH-.
A、(NH4)2SO4和OH-会反应产生氨气,不能大量共存,故选项错误.
B、H2SO4、HCl中的氢离子和碱性溶液中的中OH-在溶液中结合生成水,HCl和AgNO3在溶液中结合生成沉淀,不能大量共存,故选项错误;
C、CuCl2、Fe2(SO4)3溶液中铜离子、铁离子和碱性溶液中的中OH-在溶液中结合生成氢氧化铜、氢氧化铁沉淀,不能大量共存,且铜离子、铁离子、高锰酸根离子都带色,故选项错误;
D、四种物质在碱性溶液中相互交换成分不能生成沉淀、气体、水,能在溶液中大量共存,故选项正确;
故选D.
点评 本题考查了常见离子的共存问题,完成此题,可以依据复分解反应的实质进行,要求同学们熟记常见的酸碱盐在水中的溶解性,以便灵活应用.


科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
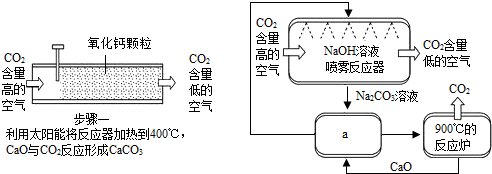
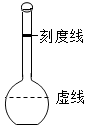 向容积为250ml的细颈玻璃仪器中加水至虚线处,如图.再滴加几滴红墨水,一段时间后,观察到的现象为:整瓶水变红,说明分子在不断的运动,继续向容器中加酒精至凹液面的最低处与刻线相切塞紧玻璃塞将液体摇匀,静置一段时间后,仪器中的现象为:液面低于刻线(且距离较远),说明分子间存在间隔,仪器细颈部分的作用是:便于观察液面变化.
向容积为250ml的细颈玻璃仪器中加水至虚线处,如图.再滴加几滴红墨水,一段时间后,观察到的现象为:整瓶水变红,说明分子在不断的运动,继续向容器中加酒精至凹液面的最低处与刻线相切塞紧玻璃塞将液体摇匀,静置一段时间后,仪器中的现象为:液面低于刻线(且距离较远),说明分子间存在间隔,仪器细颈部分的作用是:便于观察液面变化.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 镁带在空气中放置一段时间表面会氧化,其中所含的其它杂质与稀硫酸不反应.为了测定某种镁带中镁的质量分数,某实验小组进行如下实验:先用细砂纸打磨镁带表面,使用精密天平称取打磨后11.25克镁带样品放在烧杯中,每次加入40.00克稀硫酸(不考虑水的挥发)使充分反应,测量反应前后装置连同内盛物质的质量.
镁带在空气中放置一段时间表面会氧化,其中所含的其它杂质与稀硫酸不反应.为了测定某种镁带中镁的质量分数,某实验小组进行如下实验:先用细砂纸打磨镁带表面,使用精密天平称取打磨后11.25克镁带样品放在烧杯中,每次加入40.00克稀硫酸(不考虑水的挥发)使充分反应,测量反应前后装置连同内盛物质的质量.| 加入稀硫酸次数 | 1 | 2 | 3 | 4 | 5 | 6 |
| 烧杯和所称物质总质量(克) | 120.15 | 159.95 | 199.75 | 239.55 | 279.45 | 319.45 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
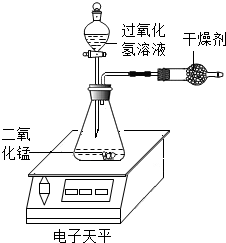 某化学兴趣小组对过氧化氢分解生成水和氧气的条件进行探究,请你参与.
某化学兴趣小组对过氧化氢分解生成水和氧气的条件进行探究,请你参与.| 实验编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| H2O2溶液浓度 | 5% | 5% | 5% | 10% | 10% | 30% | 30% |
| MnO2粉末(g) | 1.0 | 0.8 | 0.6 | 0.6 | 0.4 | 0.4 | 0.2 |
| 所用的时间(s) | 205 | 205 | 220 | 80 | 90 | 3 | 4 |
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 | 120 | 140 | 160 | 180 | 200 |
| 示数(g) | 565.40 | 565.37 | 565.34 | 565.30 | 565.28 | 565.26 | 565.24 | 565.23 | 565.22 | 565.21 | 565.20 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
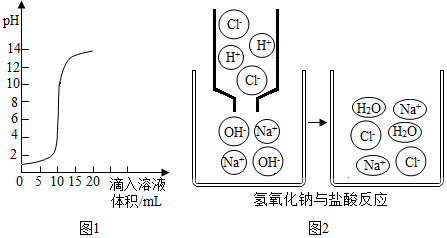
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com