(2011?丰台区一模)取某碳酸钠样品50g(含氯化钠和13%的不溶性杂质,杂质不参加化学反应),放入质量为200g的烧杯中,加137.7g水充分溶解,再向烧杯中加入300g稀盐酸恰好完全反应,测得反应后烧杯与烧杯内物质的总质量为674.5g.求所得溶液中溶质的质量分数.
【答案】
分析:运用质量守恒定律,分析变化前后质量的改变,可求出恰好完全反应所放出二氧化碳的质量,根据反应的化学方程式,由二氧化碳质量计算出生成氯化钠及样品中碳酸钠的质量,最后根据溶液中溶质质量分数计算公式求出反应后所得溶液的溶质质量分数.
解答:解:根据质量守恒定律,生成二氧化碳气体的质量为50g+200g+137.7g+300g-674.5g=13.2g
设样品中含碳酸钠的质量为x,反应后生成的氯化钠的质量为y
Na
2CO
3+2HCl═2NaCl+H
2O+CO
2↑
106 117 44
x y 13.2g
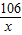
=
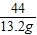
x=31.8g
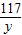
=
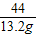
y=35.1g
所得溶液中的溶质=35.1g+(50g-31.8g-50g×13%)=46.8g
所得溶液的总质量=674.5g-200g-50g×13%=468g
所得NaCl溶液中溶质的质量分数=
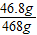
×100%=10%
答:反应后溶液中溶质的质量分数为10%.
点评:根据质量守恒定律,分析反应前后质量变化而得到生成气体二氧化碳的质量及反应后所得溶液质量,体现分析问题、解决问题的能力.

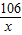 =
=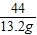 x=31.8g
x=31.8g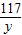 =
=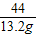 y=35.1g
y=35.1g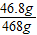 ×100%=10%
×100%=10%

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案