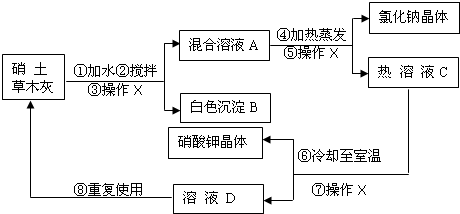
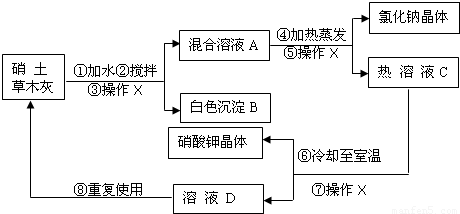
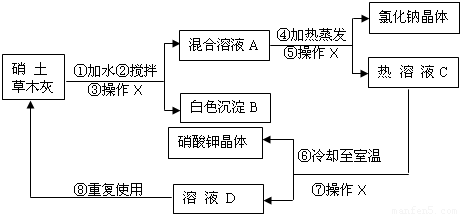
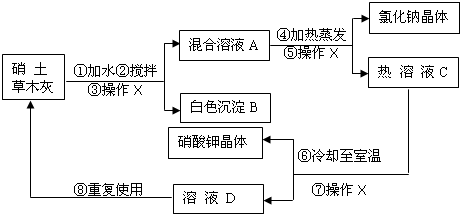
解:(1))③⑤⑦均为操作X,该操作是将固体和液体分开,为过滤;
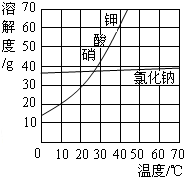
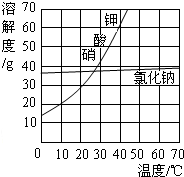
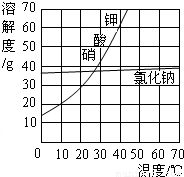
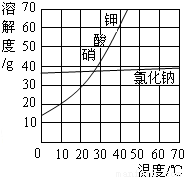
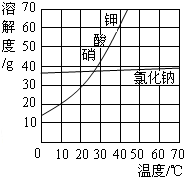
(2)用加热蒸发方法得到氯化钠晶体,而用冷却结晶法得到硝酸钾晶体的原因:NaCl的溶解度受温度变化的影响较小,而KNO
3的溶解度受温度变化的影响较大.
(3)硝酸钙与碳酸钾反应生成碳酸钙沉淀和硝酸钾,所以生成白色沉淀B的化学方程式:Ca(NO
3)
2+K
2CO
3═CaCO
3↓+2KNO
3(4)已知硝酸钙为50%的硝土40kg,则硝酸钙为20kg,根据化学方程式Ca(NO
3)
2+K
2CO
3═CaCO
3↓+2KNO
3设理论上能制取硝酸钾的质量为x,列比例式
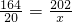
,解得x≈24.6kg;
(5)溶液D可以重复使用的原因是:滤液中仍有较多的KNO
3故答为:(1)过滤;(2)NaCl的溶解度受温度变化的影响较小,而KNO
3的溶解度受温度变化的影响较大.
(3)Ca(NO
3)
2+K
2CO
3═CaCO
3↓+2KNO
3;(4)24.6kg
(5)滤液中仍有较多的KNO
3(或重复利用滤液中的KNO
3,节约原料,提高原料的利用率)
分析:硝土中含有硝酸钙和氯化钠物质,草木灰的主要成分是碳酸钾,加水搅拌,硝酸钙与碳酸钾反应生成碳酸钙沉淀和硝酸钾,经“过滤”除掉碳酸钙沉淀B;氯化钠和硝酸钾混合溶液A加热蒸发,“过滤”得氯化钠和热溶液C硝酸钾,硝酸钾热溶液冷却至室温“过滤”得硝酸钾晶体和溶液D(溶质为硝酸钾),再回收利用.
(1)③⑤⑦均为操作X,该操作是将固体和液体分开,为过滤;
(2)由溶解度的曲线图可知:NaCl的溶解度受温度变化的影响较小,用加热蒸发方法得到氯化钠晶体;而KNO
3的溶解度受温度变化的影响较大,用冷却结晶法得到硝酸钾晶体;
(3)硝土中含有硝酸钙和氯化钠物质,草木灰的主要成分是碳酸钾,加水搅拌,硝酸钙与碳酸钾反应生成碳酸钙沉淀和硝酸钾;正确书写此反应的化学方程式;
(4)已知硝酸钙为50%的硝土40kg,则硝酸钙为20kg,根据化学方程式Ca(NO
3)
2+K
2CO
3═CaCO
3↓+2KNO
3可求出理论上能制取硝酸钾的质量;
(5)硝酸钾热溶液冷却知室温得硝酸钾晶体和溶液D(溶质为硝酸钾),溶液D还有较多的硝酸钾.
点评:本题主要考查了混合物的分离方法,掌握过滤和结晶的方法步骤,了解酸碱盐的应用.

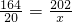 ,解得x≈24.6kg;
,解得x≈24.6kg;