
科目:初中化学 来源: 题型:阅读理解
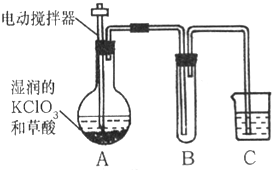 (2006?烟台)用氯气消毒饮用水时,会生成少量对人体有害的有机物.因此,世界环保联盟建议全面禁止用氯气对饮用水消毒,推广使用安全、高效杀菌消毒剂ClO2.ClO2是一种黄绿色、有刺激性气味的气体,冷却至11.0℃以下时变成红色液体,易溶于水,见光易分解.ClO2易与碱反应,其杀菌、漂白能力均优于氯气,消毒水体时不生成有害物质,也不存在用氯气消毒时残留的气味.
(2006?烟台)用氯气消毒饮用水时,会生成少量对人体有害的有机物.因此,世界环保联盟建议全面禁止用氯气对饮用水消毒,推广使用安全、高效杀菌消毒剂ClO2.ClO2是一种黄绿色、有刺激性气味的气体,冷却至11.0℃以下时变成红色液体,易溶于水,见光易分解.ClO2易与碱反应,其杀菌、漂白能力均优于氯气,消毒水体时不生成有害物质,也不存在用氯气消毒时残留的气味.查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 (2012?门头沟区二模)随着人们生活水平的提高,人们对于食品不但要求营养,更要求健康.市场上出现了一些不添加防腐剂的绿色食品,这种食品中有一个单独包装的保鲜剂,不会危害食品安全.某同学找来一种在空气中放置一段时间的食品保鲜剂,对它进行探究.
(2012?门头沟区二模)随着人们生活水平的提高,人们对于食品不但要求营养,更要求健康.市场上出现了一些不添加防腐剂的绿色食品,这种食品中有一个单独包装的保鲜剂,不会危害食品安全.某同学找来一种在空气中放置一段时间的食品保鲜剂,对它进行探究.| 实验 | 操作 | 主要现象 | 结论与解释 |
| 实验1 初步判断 |
打开这种保鲜剂的包装袋,取少量样品于试管中,进行观察. | 该样品为黑色 固体 |
该保鲜剂一定不是 ②⑤ ②⑤ . |
| 实验2 对该保鲜剂的有效性进行探究 |
向实验1的试管中加入过量的稀盐酸,振荡. |
有气泡产生,溶液逐渐变成浅绿色. | 该保鲜剂: 有效 有效 . |
| 实验3 对该保鲜剂的成分进行探究 |
 |
澄清石灰水变浑浊. | 该保鲜剂中一定含有的物质是 Fe和Fe2O3 Fe和Fe2O3 . |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||

查看答案和解析>>
科目:初中化学 来源: 题型:

| ||
| ||
| 催化剂 |
| 氧气 |
| 水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com