
���������ڹ���������������Ҫ�����ã�ͼ1Ϊ�ߩ�15�ɻ�������������ɣ�

��1�����Ͻ���������ɻ�����ǣ����Ͻ���ʵ���Ҫ�ŵ��� �� ��
��2����װǰ�������������⼣�߰ߣ���������ʴ��Ҫ����������е� ��ͬ���õĽ������ҵ�����г���ϡ�����ȥ����Ʒ��������⣬�÷�Ӧ�Ļ�ѧ����ʽΪ ��
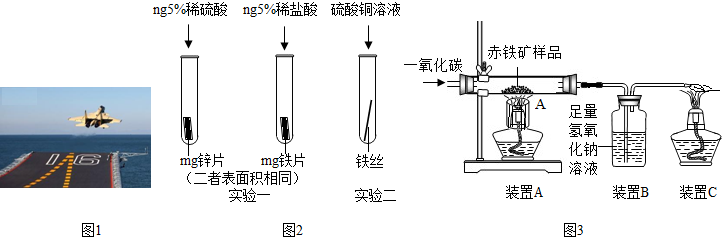
��3��Ϊ�˱����ִ��ĸ�����DZ���ʴ��ͨ�����ִ��������Ƕ�������ǿ������С��Ϊ̽��п������ͭ���ֽ����Ļ��˳���������ͼ2������ʵ�飺
��ʵ��һ�У�С���ԡ���������������ݵĿ�����Ϊ�����ж�п�����Ļ��ǿ������ͬѧ��Ϊ���������������� ��
��ʵ����У������� ����֤�����Ļ��ǿ��ͭ���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��4���������Ľ���ķ��˴����ĸֲģ�ij��ȤС����ʵ������ͼ3��ʾװ��ģ�������Ļ�ѧԭ�������ⶨ��������������������������װ�����������ã���Ӧ��ȫ�ҳ������е����ʲ��μӷ�Ӧ�����س�������Ʒ������Ϊwg����
��װ��A���������Ļ�ѧ����ʽΪ ��װ��B�з�����Ӧ�Ļ�ѧ����ʽΪ ��
��Ҫ�ⶨ�ó�������Ʒ����������������������Ҫ������������ ��
��1��ǿ�ȴ������� ��2��������ˮ��Fe2O3+6HCl�T2FeCl3+3H2O
��3����ѡȡ��������ͬ ����˿������ֺ�ɫ���ʣ�Fe+CuSO4�TFeSO4+Cu
��4����Fe2O3+3CO 2Fe+3CO2��2NaOH+CO2�TNa2CO3+H2O
2Fe+3CO2��2NaOH+CO2�TNa2CO3+H2O
�ڷ�Ӧ��װ��A��ҩƷ�������������Ӧǰ��װ��B���ӵ�������
��������
�����������1�������Ͻ����ǿ�ȴ������ᣬ�������Ͻ����������ɻ�����ǣ�
�ʴ�Ϊ��ǿ�ȴ������
��2����������ʴ��ʵ����������ˮ��������ͬ���õĽ����ϡ����������е���������Ӧ�������Ȼ�����ˮ����Ӧ�Ļ�ѧ����ʽΪ��Fe2O3+6HCl�T2FeCl3+3H2O��
�ʴ�Ϊ��������ˮ��Fe2O3+6HCl�T2FeCl3+3H2O��
��3���ٴ�ͼ���Կ���ѡȡ��������ͬ������ԡ���������������ݵĿ�����Ϊ�����ж�п�����Ļ��ǿ������������
�ʴ�Ϊ��ѡȡ��������ͬ��
��ʵ����У�����˿������ֺ�ɫ���ʣ���֤�����Ļ��ǿ��ͭ���÷�Ӧ�Ļ�ѧ����ʽΪFe+CuSO4�TFeSO4+Cu��
�ʴ�Ϊ����˿������ֺ�ɫ���ʣ�Fe+CuSO4�TFeSO4+Cu��
��4����һ����̼�ڸ����»�ԭ�������������Ͷ�����̼����Ӧ�Ļ�ѧ����ʽ��Fe2O3+3CO 2Fe+3CO2��������̼���������Ʒ�Ӧ����̼���ƺ�ˮ����Ӧ�Ļ�ѧ����ʽ��2NaOH+CO2�TNa2CO3+H2O��
2Fe+3CO2��������̼���������Ʒ�Ӧ����̼���ƺ�ˮ����Ӧ�Ļ�ѧ����ʽ��2NaOH+CO2�TNa2CO3+H2O��
�ʴ�Ϊ��Fe2O3+3CO 2Fe+3CO2��2NaOH+CO2�TNa2CO3+H2O��
2Fe+3CO2��2NaOH+CO2�TNa2CO3+H2O��
�ڳ�������Ʒ������Ϊwg�����ֻҪ�����Ӧ��װ��A��ҩƷ���������Ϳɼ������Ӧǰ����ٵ����������ٵ����������������������������Ӷ�����������������������������������������������
������Ӧǰ��װ��B���ӵ������������ɵĶ�����̼�����������ݶ�����̼�������ټ���������������������������������������������
�ʴ�Ϊ����Ӧ��װ��A��ҩƷ�������������Ӧǰ��װ��B���ӵ�������
���㣺�Ͻ���Ͻ�����ʣ��������˳����Ӧ�ã�һ����̼��ԭ��������������ʴ�����������������Ļ�ѧ���ʣ���д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ��
�����������ѶȽϴ����ճ����Ͻ���ŵ㡢������ʴ��ԭ���ͳ���ԭ���Լ�����ʵ�������������ⷽ���ǽ������Ĺؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| ||
| ||
| ʵ�鲽�� | ʵ������ | ʵ����� |
�ֱ�ȡ��������ͭ��Һ������п��Һ����֧�Թ��У�����˿�ֱ��������Һ�У��۲����� �ֱ�ȡ��������ͭ��Һ������п��Һ����֧�Թ��У�����˿�ֱ��������Һ�У��۲����� |
��������ͭ��Һ�е���˿������ֺ�ɫ���壬��Һ����ɫ��Ϊdz��ɫ����������п��Һ����˿�����Ա仯�� ��������ͭ��Һ�е���˿������ֺ�ɫ���壬��Һ����ɫ��Ϊdz��ɫ����������п��Һ����˿�����Ա仯�� |
�������˳�� Zn��Fe��Cu �������˳�� Zn��Fe��Cu |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
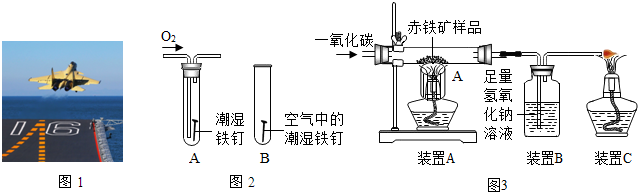
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013��ɽ��ʡ��̨���п���ѧ�Ծ��������棩 ���ͣ������
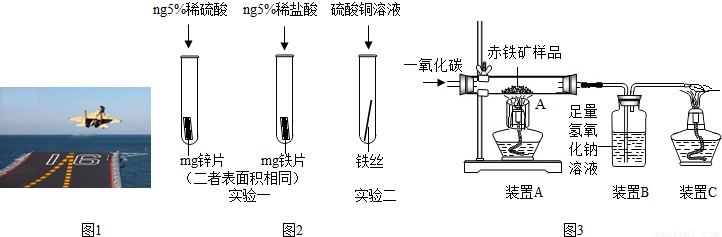
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com