
【题目】请按下列要求选择合适的物质填空(填化学式或化学方程式)。
(1)铅酸蓄电池中含有的酸_________;
(2)作食品干燥剂的是__________;
(3)生理盐水的溶质是__________;
(4)炉具清洁剂含有的碱与二氧化碳反应__________;
(5)铝有很好的抗腐蚀性能的原因___________;
(6)赤铁矿炼铁的原理_________。
【答案】H2SO4 CaO NaCl 2NaOH +CO2=Na2CO3+H2O 4Al+3O2=2Al2O3 Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
【解析】
(1)铅酸蓄电池中含有的酸是H2SO4;
(2)CaO能与水反应,可作食品干燥剂;
(3)生理盐水的溶质是NaCl;
(4)炉具清洁剂含有的碱是NaOH,其能与二氧化碳反应,反应的化学方程式为:2NaOH +CO2=Na2CO3+H2O;
(5)铝有很好的抗腐蚀性能的原因是常温下,铝与空气中的氧气反应生成了一层致密的氧化铝薄膜,阻止铝进一步被氧化,反应的化学方程式为:4Al+3O2=2Al2O3;
(6)赤铁矿主要成分是氧化铁,炼铁的原理为:Fe2O3+3CO![]() 2Fe+3CO2。
2Fe+3CO2。


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】A~H都是初三化学前三个单元中的常见物质,A、B均为黑色粉末,C、D在常温时均呈液态,B和C混合立即产生大量的无色气体H,H能使带火星的木条复燃,加热E和B的混合物也有H气体生成,它们之间有如下的转化关系,且B在反应①和③中前后质量和化学性质均不变,试回答下列问题:
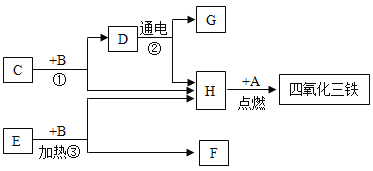
(1)写出下列物质的名称
D、_____,F、_____
(2)写出H和A反应的符号表达式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】食盐是一种重要的化工原料,请回答下列问题。
(1)请完善实验室除去粗盐中泥沙等难溶性杂质的实验步骤。
![]()
①操作Ⅰ所用的玻璃仪器有:烧杯、玻璃棒和_____。
②在蒸发过程中,待_____时,停止加热,利用余热将滤液蒸干。
(2)由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。
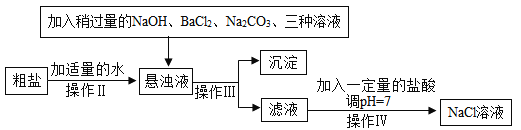
加入稍过量的Na2CO3溶液除了能除去粗盐中的CaCl2外,它还有一个作用是(用化学方程式表示)_____,加入的三种溶液中,_____ 两种溶液可以用_____ 一种溶液替代。
(3)若有溶质质量分数为10%的氯化钠不饱和溶液100 kg,要将其变成20 ℃时氯化钠的饱和溶液,以满足化工生产的需要,可采用的最简便方法是_____(已知:20℃时氯化钠的溶解度为36g)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】溶液在生产生活中有着广泛的应用。
(1)0℃时,101Kpa 时氮气溶解度为 0.024,其意义 为:________。
(2)甲、乙两种固体物质的溶解度曲线如下图所示, 析出的晶体均不含结晶水,回答下列问题:
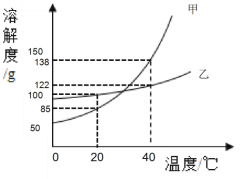
①乙物质的溶解性属于________(填“易溶”或 “可溶”或“微溶”或“无法确定”)。
②A 是 40℃含有 120g 水的甲溶液,经过如下操作, 得到 50g 甲固体。
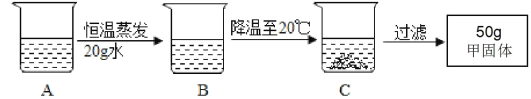
对以上过程的分析,正确的是________(选填编号)
a A 到 B 的过程中,溶质质量没有改变 b B 中溶质与溶剂的质量比为 138:100
c B 到 C 的过程中,溶质甲已全部析出 d A 溶液的质量等于 255g
③40℃,将甲、乙物质饱和溶液各 200g 降温至 20℃,对此过程判断一定正确的是________。
Ⅰ.现象:有析出晶体,甲溶液析出固体质量>乙溶液析出固体质量
Ⅱ.溶解度:溶解度都变小;20℃时:S 甲<S 乙
Ⅲ.溶液状态:都为饱和溶液;40℃:甲溶质的质量<乙溶质的质量
Ⅳ.溶剂变化:溶质质量不变;20℃时:甲溶液中溶剂质量>乙溶液中溶剂质量
④40℃,向 100g 水中加入 143g 甲物质,搅拌后发现全部溶解,但放置一段时间后又有少量 甲物质的晶体析出(不考虑甲与空气中的物质反应和水的蒸发),“全部溶解”的原因可能 是________ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室配制50克质量分数为12%的氯化钠溶液。下图是小军实验操作过程示意图:
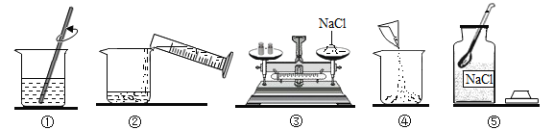
(1)请指出图中一处明显错误的操作_________;改正操作后,用上述图示的序号表示配制溶液的正确操作顺序________;
(2)图①中玻璃棒搅拌的目的是_______;
(3)配制该溶液需要用_________的量筒(填“50mL”、“100mL”或“200mL”)量取水。用己调节平衡的天平称取氯化钠固体时,发现指针偏右,接下来的操作是_______;
(4)经检验,该同学配制的溶液溶质质量分数偏小,可能的原因是_____ ( 填序号)
A 氯化钠固体不纯
B 用生锈的砝码称量
C 装瓶时有少量液体洒出
D 用量筒量取水时,俯视读数
E 溶解的烧杯提前用蒸馏水润洗
(5)将20克12%的氯化钠溶液配制成6%的氯化钠溶液,需加水______克。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】黄铜是铜和锌的合金。为了测定某黄铜中铜的质量分数,称取10.0g黄铜样品置于烧杯中,慢慢加入稀硫酸使其充分反应,直至固体质量不再减少为止,此时共用去98.0g稀硫酸,将反应后的剩余物过滤、干燥,称得剩余固体3.5g。试计算:
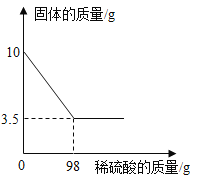
求:(1)铜样品中锌的质量是______(直接填结果);
(2)所用稀硫酸溶液的溶质质量分数是_____?(写过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】资料显示:在一定温度下,往煤中加入适量石灰石粉,其分解产物可使煤(含S)燃烧时产生的SO2转化成CaSO4,从而减少SO2排放,该方法被称为钙基固硫。某实验小组利用下列实验装置和药品对其可行性进行了模拟探究。
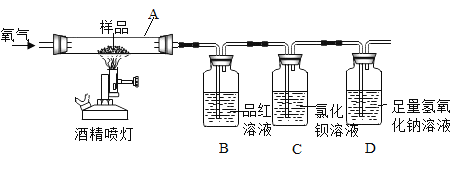
①SO2与CO2为非金属氧化物,均能与碱溶液反应,但SO2有毒,能与品红作用使其褪色。
②2SO2+2H2O+O2+2BaCl2=2BaSO4↓+4HCl
③CO2不与BaCl2溶液反应
(实验一)取S粉与CaCO3粉末的混合物装入A中,连续通入过量O2,加热至500℃左右,充分反应后,发现B中红色消失、C中出现大量的白色浑浊。
(1)停止实验的正确操作是_____。
(2)装置D中NaOH的作用是_____。
(实验二)另取上述S粉与CaCO3粉末的混合物装入A中,连续通入过量O2,并迅速加热升温,控制在1000℃左右,充分反应后,发现B中红色消失,C中出现少量的白色浑浊。
(3)取反应后D中溶液滴加过量盐酸,出现大量无色气泡(其中有CO2)。反应结束后,经实验检验A中余下固体含有CaSO4,由此得知实验二过程中,A中发生的反应有三个,请完成剩余的两个化学方程式:
①S+O2![]() SO2;
SO2;
②_____;
③_____。
(实验三)另取CaSO4粉末装入A中,连续通入过量O2,加热至1200℃左右,充分反应,发现B中红色消失。
(4)比较实验一、二、三可知,如用该方法固硫,适宜的温度条件是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2019年为“元素周期表年”,元素周期表是学习和研究化学的重要工具。原子序数为1-18的元素在元素周期表中的部分信息如图所示。请回答下列问题:
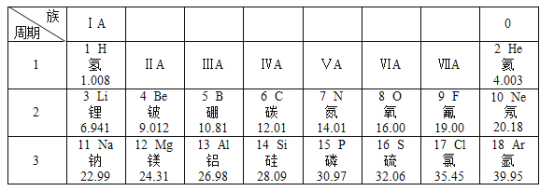
(1)一个磷原子的质子数为_____。
(2)铝属于_____(填“金属”或“非金属”)元素,在化学反应中容易_____(填“得”或“失”)电子,形成的铝离子的化学符号为_____。
(3)表中3至10号元素位于第二周期,11至18号元素位于第三周期,分析其规律可知,每一周期元素原子的_____相同。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“见微知著”,研究微观是化学学习中重要的内容,有以下表述:
①氯气: Cl2;
②由三个氧原子构成的臭氧分子: 3O;
③粒子结构示意图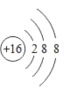 表示的粒子: S2+;
表示的粒子: S2+;
④两个铁离子: 2Fe2+;
⑤导电、导热性最好的金属: Ag;
⑥+2价的镁元素: Mg+2。 其中正确的有( )
A.②④⑤B.①⑤C.①③⑤D.①④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com