【答案】
分析:①依据生石灰的化学式回答,并依据反应流程和石灰石煅烧的反应原理分析;
②依据石灰石与稀盐酸反应原理书写方程式,并分析流程中发生的化学反应,化合反应是生成一种物质的反应;
③依据石灰石的质量求出碳酸钙的质量,再计算其物质的量,并依据方程式以及碳酸钙的物质的量计算盐酸的物质的量;
④根据反应流程和操作分析解答;并据熟石灰溶于水显碱性及碳酸钙不溶于水设计实验进行分析;
⑤第一次过滤的目的是去除不溶于盐酸的杂质,提高所制取的碳酸钙的纯度;过滤后发现滤液仍有一些浑浊,应再次过滤;
⑥根据两个反应流程所得碳酸钙的纯度分析判断.
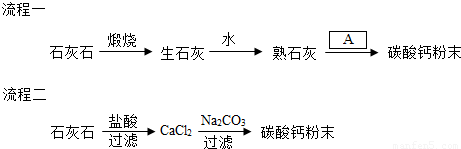
解答:解:①生石灰的化学式是CaO,石灰石煅烧生成二氧化碳,可以通入熟石灰与之反应,节省了原料;
②石灰石与稀盐酸反应生成氯化钙、水和二氧化碳,方程式是2HCl+CaCO
3=CaCl
2+CO
2↑+H
2O;
流程一中石灰石高温分解生成氧化钙和二氧化碳,属于分解反应;生石灰和水反应生成氢氧化钙,属于化合反应;熟石灰可与二氧化碳反应生成碳酸钙和水,不属于基本反应类型;流程二:石灰石与盐酸反应生成氯化钙、水和二氧化碳,属于复分解反应;氯化钙和碳酸钠反应生成碳酸钙和氯化钠也属于分解反应;
③100g石灰石所含碳酸钙的质量是100g×90%=90g,则其物质的量为
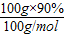
=0.9mol;
设理论上所用盐酸含HCl的物质的量至少为x
2HCl+CaCO
3=CaCl
2+CO
2↑+H
2O
2 1
x 0.9mol
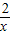
=
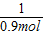
x=1.8mol
答:理论上所用盐酸含HCl的物质的量至少为1.8mol.
④“流程一”中生石灰加一定量的水得到熟石灰乳,而不是得到澄清石灰水,这样做的目的是得到的石灰乳体积较小,有利于实验进行;
熟石灰溶于水显碱性,碳酸钙不溶于水,故可取少量样品滴加酚酞,根据实验结论:熟石灰已完全转化,所以固体中没有熟石灰,酚酞不变色;
⑤第一次过滤的目的是去除不溶于盐酸的杂质,提高所制取的碳酸钙的纯度;过滤后发现滤液仍有一些浑浊,应再次过滤,提高所得滤液的纯度;
⑥要得到食品级碳酸钙,则碳酸钙的纯度要较高,流程一石灰石中的杂质未除去,所得碳酸钙纯度不如流程二所得碳酸钙的纯度高,故倾向于利用流程二制取碳酸钙;
故答案为:①CaO;利用碳酸钙分解得到的产物,节省了原料;
②2HCl+CaCO
3=CaCl
2+CO
2↑+H
2O;CaO+H
2O═Ca(OH)
2;
③

=0.9mol;
设理论上所用盐酸含HCl的物质的量至少为x
2HCl+CaCO
3=CaCl
2+CO
2↑+H
2O
2 1
x 0.9mol
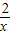
=

x=1.8mol
答:理论上所用盐酸含HCl的物质的量至少为1.8mol.
④得到的石灰乳体积较小,有利于实验进行;
| 实验药品及操作 | 实验现象 | 结论 |
| 加水溶解再滴加酚酞 | 溶液不变红 | 熟石灰已完全转化 |
⑤去除不溶于盐酸的杂质,提高碳酸钙的纯度;再次过滤;
⑥流程二.
点评:本题通过实验流程的形式考查了学生对物质的分离、实验设计、碳酸钙和氧化钙、氢氧化钙之间的相互转化等知识,有一定难度,掌握相关知识且能结合具体情景才能正确解答.

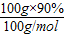 =0.9mol;
=0.9mol;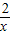 =
=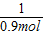
 =0.9mol;
=0.9mol;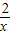 =
=


 阅读快车系列答案
阅读快车系列答案