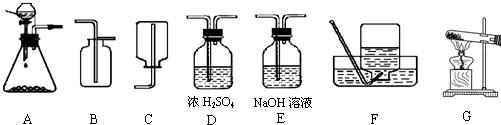
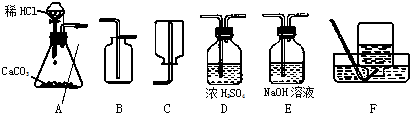
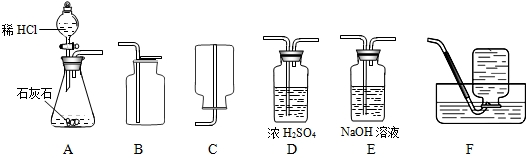
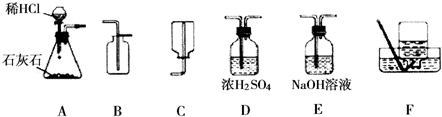
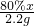解:解:(1)收集二氧化碳气体只能用向上排空气集气法,因为二氧化碳气体密度比空气大,且能溶于水,所以应该用B装置来作为收集装置,而干燥二氧化碳气体应该用D装置,利用浓硫酸的吸水性,不能用氢氧化钠溶液,因为NaOH溶液能和二氧化碳反应;
(2)实验室中用大理石和稀盐酸反应来制取二氧化碳,大理石的主要成分碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,化学方程式为CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑;
(3)设需含碳酸钙80%的石灰石的质量为x
CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑;
100 44
80%x 2.2g

=
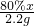
x=6.25g
答:需含碳酸钙80%的石灰石的质量为6.25g;
(4)在确保气密性良好的前提下实验中气体无法收集满,则可能的原因是:盐酸或大理石的量不足.
故答案为:(1)D、B;
(2)CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑;
(3)6.25g;
(4)盐酸的量不足.
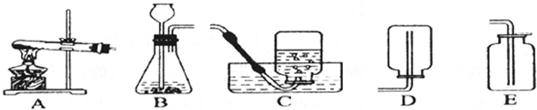
分析:(1)①二氧化碳的制取:固体+液体反应,不需加热,发生装置选A;②干燥的CO2气体:用D装置,利用浓硫酸的吸水性能把气体中的水蒸气吸收而除去;③收集二氧化碳气体只能用向上排空气集气法,因为其密度比空气大,选用B装置.
(2)根据书写化学方程式的原则书写
(3)根据化学方程式,已知生成的二氧化碳的质量可求出石灰石的质量.
(4)本小题,为开放性题目,可能的原因有多种答案.
点评:该题为实验室制取二氧化碳的一道综合题,考查二氧化碳的实验室制法原理、制取装置、收集装置的选择,以及二氧化碳的某些性质:NaOH溶液能和二氧化碳反应.

 =
=