(2013?南京二模)(1)銨磷钾是根据实际需要加工配制的复合肥料,因为它同时含有氮、
磷
磷
、
钾
钾
三种营养元素.
(2)如图实验:
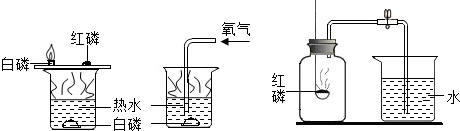
①磷燃烧的化学反应方程式
;
②该实验是通过控制哪些因素来探究可燃物燃烧的条件?
可燃物是否与氧气接触,可燃物是否达到燃烧所需的温度
可燃物是否与氧气接触,可燃物是否达到燃烧所需的温度
(3)①甲同学:点燃红磷立即伸入瓶中并塞上瓶塞.待红磷燃烧停止并冷却后,打开止水夹,观察到集气瓶中吸入水的体积约占集气瓶空气体积的
1/5
1/5
;
②乙同学:用碳替代红磷,完成上述实验,发现集气瓶内并没有吸入水,其原因是
碳燃烧生成物是二氧化碳气体,瓶内气压不变
碳燃烧生成物是二氧化碳气体,瓶内气压不变
③丙同学:向集气瓶中加入少量的氢氧化钠溶液,然后完成乙同学的实验,他认为能得到与甲同学相同的实验结果了.你认为呢?(说出理由)
不能,因为碳在氧气不足时燃烧生成一氧化碳,一氧化碳不溶于氢氧化钠溶液
不能,因为碳在氧气不足时燃烧生成一氧化碳,一氧化碳不溶于氢氧化钠溶液
(4)“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO
2分离出来进行储存和利用.常利用NaOH溶液来“捕捉”CO
2,过程如下图所示(部分条件及物质未标出).
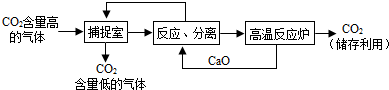
①NaOH溶液“捕捉”CO
2的化学反应方程式为
CO2+2NaOH=Na2CO3+H2O
CO2+2NaOH=Na2CO3+H2O
②整个过程中,可以循环利用的物质有
NaOH、CaO
NaOH、CaO
③将CO
2压缩后贮藏于深海,CO
2在深海中的溶解度比在通常情况下在水中的溶解度大,原因是
深海中压强大、温度低,气体(CO2)在水中的溶解度增大
深海中压强大、温度低,气体(CO2)在水中的溶解度增大
.



 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 (2013?南京)下表所示各组物质中,物质之间按箭头方向通过一步反应就能实现如图所示转化的是( )
(2013?南京)下表所示各组物质中,物质之间按箭头方向通过一步反应就能实现如图所示转化的是( )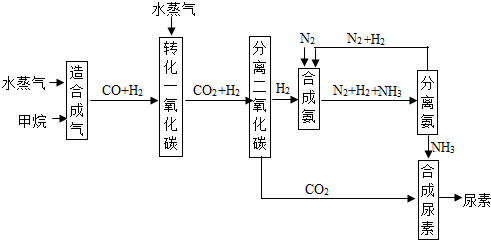
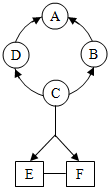 (2013?南京二模)如图所示A~F是初中化学常见的物质.图中“→”表示转化关系,“-”表示相互能反应(部分物质和反应条件未标出).其中A是紫红色金属,B常温下是气体,C是人体胃液中含有的酸.则下列说法正确的是( )
(2013?南京二模)如图所示A~F是初中化学常见的物质.图中“→”表示转化关系,“-”表示相互能反应(部分物质和反应条件未标出).其中A是紫红色金属,B常温下是气体,C是人体胃液中含有的酸.则下列说法正确的是( )
