
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量固体放于试管中,加入蒸馏水充分搅拌 | 用手触摸试管,试管外壁发烫 | 固体中一定含有氧化钙 |
| ②另取少量固体放于试管中,滴加足量稀盐酸 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液 | 固体中一定含有铁,一定不含Fe2O3 |
| ③将步骤②中产生的气体通入澄清的石灰水中 | 澄清石灰水变浑浊 | 固体中一定含有CaCO3 |
分析 【查阅资料】化学反应前后,元素种类不变,原子种类和总个数不变;
【作出猜想】氧化钙能和水反应生成氢氧化钙;
【实验探究】氧化钙和水反应时放出大量的热;
铁能和稀盐酸反应生成氯化亚铁和氢气;
二氧化碳能使澄清石灰水变浑浊;
【实验质疑】稀盐酸能和氧化铁反应生成氯化铁和水,氯化铁能和铁反应生成氯化亚铁;
铁能被磁铁吸引.
解答 解:【查阅资料】
根据质量守恒定律可知,铁与氯化铁溶液在常温下反应的化学方程式为:Fe+2FeCl3═3FeCl2.
故填:FeCl2.
【作出猜想】
久置固体中可能含有Ca(OH)2的原因是氧化钙和水反应生成了氢氧化钙,反应的化学方程式为:CaO+H2O═Ca(OH)2.
故填:CaO+H2O═Ca(OH)2.
【实验探究】
实验过程如下表所示:
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量固体放于试管中,加入蒸馏水充分搅拌 | 用手触摸试管,试管外壁发烫 | 固体中一定含有氧化钙 |
| ②另取少量固体放于试管中,滴加足量稀盐酸 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液 | 固体中一定含有 铁,一定不含Fe2O3 |
| ③将步骤②中产生的气体通入澄清的石灰水中 | 澄清石灰水变浑浊 | 固体中一定含有CaCO3 |
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:选择题
| A. | 火上浇油:增大可燃物与氧气的接触面 | |
| B. | 钻木取火:提高可燃物的温度达到着火点 | |
| C. | 吹灭烛火:降低着火点 | |
| D. | 电器着火:用水浇灭 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 唾液(6.6~7.1) | B. | 胆汁(7.1~7.3) | C. | 胃液(0.9~1.5) | D. | 血浆(7.35~7.45) |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 预期现象 | 结论 |
| 取少量反应后得到的溶液于试管中,滴入碳酸钠溶液. | 无明显现象 | 你的猜想不正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 操作 | 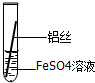 甲 | 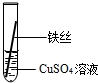 乙 | 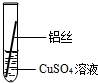 丙 | 根据现象得出金属活动性顺序 |
| 现象 | 铝丝表面附着银白色固体 | 铁丝表面附着红色固体 | 铝丝表面附着红色固体 | Al>Fe>Cu |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
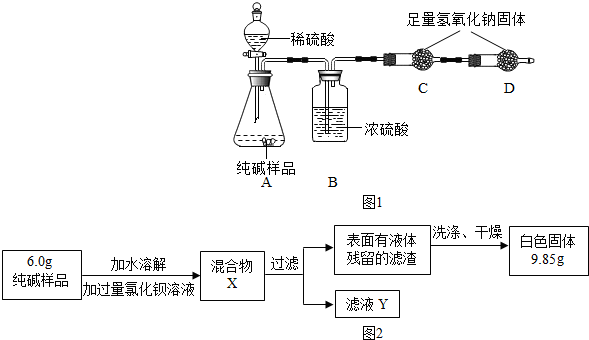
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 阳离子 阴离子 | OH- | CL- | SO${\;}_{4}^{2-}$ | CO${\;}_{3}^{2-}$ |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 不 | 不 |
| Mg2+ | 不 | 溶 | 溶 | 不 |
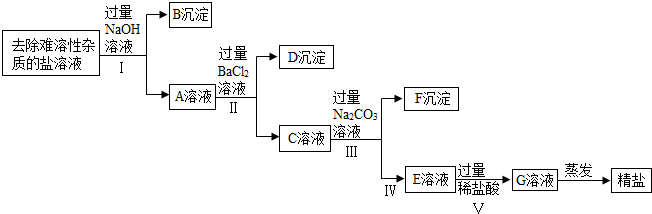
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
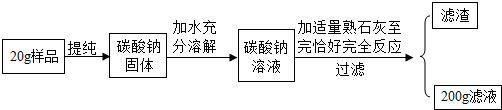
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 反应前后氧元素的化合价不变 | B. | 此反应属于复分解反应 | ||
| C. | x为11 | D. | 反应前后固体质量不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com