
【题目】合成气可通过天然气的重整得到,如CH4+H2O═CO+3H2.合成气可制二甲醚,二甲醚被称为21世纪的新型燃料。合成气还可用于冶炼金属,用它冶炼铁的部分生产过程示意如图:

(1)二甲醚(CH3OCH3)可由合成气(CO和H2)在一定的条件下制得。用合成气制二甲醚时,还产生了一种可参与大气循环的、常温下为液态的氧化物,写出该反应的化学方程式:_____。
(2)合成气在冶炼铁的生产过程中所起的作用是_____。
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】菱镁矿的主要成分是MgCO3,为了分析某菱镁矿中MgCO3的含量,学习小组进行了实验研究.取10克菱镁矿样品,向其中逐滴加入未知质量分数的H2SO4溶液,生成的气体全部用NaOH溶液吸收,NaOH溶液增加的质量记录如表:
加入H2SO4溶液的质量/g | 50 | 100 | 150 | 200 |
NaOH溶液增加的质量/g | 2.2 | 4.4 | 4.4 | 4.4 |
(假设菱镁矿中的杂质不溶于水,不与酸发生反应.)
(1)10克菱镁矿与H2SO4溶液完全反应,生成CO2的质量为_____.
(2)该菱镁矿中MgCO3的质量分数是多少?____
(3)该实验研究中所用H2SO4溶液的溶质质量分数是多少?____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据如图回答问题。
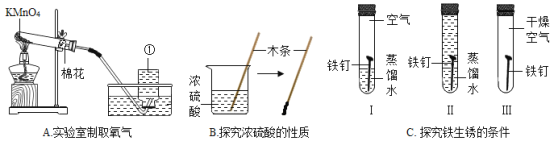
(1)A中仪器①的名称是_____,发生反应的化学方程式是_____。试管中加一团棉花的作用是_____。
(2)B中观察到的现象是_____。
(3)C中会出现明显现象的是试管_____(填序号),试管Ⅱ中的蒸馏水需要煮沸、迅速冷却后再使用,目的是_____。该实验说明铁生锈是铁和空气中的_____共同作用的结果。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知A-F是初中化学中常见的六种不同物质,它们之间的转化关系如图所示(部分反应物、生成物及反应条件已略去)。其中A为红棕色粉末,C为黑色固体,B、E的组成元素相同,A与F中不含有相同的元素,F是一种不溶于稀硝酸的白色固体,请回答下列问题:

(1)F的化学式是______;
(2)写出A→B的化学方程式:______;
(3)写出A→D的化学方程式:______;
(4)上述转化过程中没有涉及的化学基本反应类型是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】专家指出,反式脂肪酸会影响身体发育,而生日蛋糕里的人造奶油可能会产生一种反式脂肪酸。其化学式是 C18H34O2,请回答:(计算结果保留小数点后一位)
(1)反式脂肪酸的相对分子质量是_____。
(2)反式脂肪酸中碳氢氧三种元素的质量比是_____。
(3)反式脂肪酸中氧元素的质量分数为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为测定某碳素钢样品中铁的质量分数,现取一定质量的样品粉末于质量为51.8g的烧杯中,然后逐步加入一定质量分数的稀硫酸,当加入80g稀硫酸时反应恰好完全,加入稀硫酸的质量与烧杯及烧杯内物质的总质量的关系如图.试通过计算完成下列填空:(不能整除时,结果保留一位小数)

(1)该实验取用的样品质量为:_____g;
(2)样品中铁的质量分数为:_____;
(3)小王不慎在反应结束后,向烧杯中多加了20g稀硫酸,此时,溶液中亚铁离子在溶液总质量中的质量分数为:_____,若在该图象中补绘此过程中稀硫酸的质量与烧杯及烧杯内物质的总质量的关系图,所得线段的终点位于线段AB延长线的_____(填“上方”、“下方”或“线上”).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用化学用语填空
(1)氦气的化学式_________
(2)烧碱的化学式__________
(3)2个铵根离子____________
(4)铝的离子结构示意图为_____________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学对氢化钙(CaH2)的制备和性质进行了如下探究:

(阅读资料)
①H2与钙加热可制得CaH2;
②钙和氢化钙都能和水反应,生成物都是一种碱和一种气体;
(实验探究)设计的制取装置如图所示:
(1)碱石灰的主要成分为氧化钙和氢氧化钠,装置B的作用是_____;根据完整的实验装置进行实验,实验步骤如下:检查装置气密性、装入药品、打开分液漏斗活塞,此后实验步骤正确的顺序序号是_____
A 加热反应一段时间;B 收集装置最右端导管口处的气体并检验其纯度;C 关闭分液漏斗活塞;D 停止加热,充分冷却。
(2)制备CaH2实验结束后,取少量反应后固体小心加入水中,观察到有气泡产生,在溶液中滴入石蕊试液后显_____色。该同学据此判断:实验中确有氢化钙生成,其他同学认为他的结论不一定正确,原因是_____。
(3)取少量上述制得的CaH2样品加到足量的碳酸钠溶液中,产生大量气泡,过滤得滤渣和滤液,经检验滤渣的成分是碳酸钙,点燃产生的气体,火焰呈淡蓝色,将燃烧产物通入澄清石灰水中,无现象,则该气体为_____(写化学式)。
(4)对滤液中溶质的成分做出如下猜测并进行实验:
猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因_____。
(实验验证)
实验 | 现象 | 结论 |
实验一:取滤液,向其中滴入少量Na2CO3溶液 | _____ | 猜想二不成立 |
实验二:另取滤液,向其中加入足量稀盐酸 | _____ | 猜想三成立 |
(定量分析)
取制得的CaH2样品a克(已知样品为CaH2和Ca的混合物,其中CaH2的质量分数为84%),加到足量的Na2CO3溶液中,充分反应后得48gCaCO3,则a的值为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为测定某盐酸溶液的溶质质量分数,现取出盐酸溶液100g,向其中滴加一定浓度的AgNO3溶液,至不再产生沉淀为止,共用去80g,过滤后得滤液122.6g。请计算:
(1)该反应产生的沉淀质量
(2)稀盐酸溶液溶质质量分数。(提示:HCl+AgNO3=AgCl↓+HNO3) (H﹣1;Cl﹣35.5;Ag﹣108;N﹣14;O﹣16)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com