

分析 (1)根据氢氧化钙的俗名,进行分析解答.
(2)根据酸的化学性质(能与酸碱指示剂、活泼金属、金属氧化物、碱、碳酸盐等反应),进行分析解答.
(3)氢氧化钙与纯碱反应生成碳酸钙沉淀和氢氧化钠,写出反应的化学方程式即可.
解答 解:(1)氢氧化钙俗称熟石灰或消石灰.
(2)①稀盐酸不能使酚酞溶液变色,不能用于验证稀盐酸是否过量.
②锌粒能与稀盐酸反应生成氢气,能用于验证稀盐酸是否过量.
③Fe2O3与稀盐酸反应生成氯化铁和水,会观察到氧化铁溶解,溶液变黄色,能用于验证稀盐酸是否过量.
④NaOH与稀盐酸反应生成氯化钠和水,但无明显变化,不能用于验证稀盐酸是否过量.
⑤AgNO3溶液与氯化钠、盐酸反应均生成氯化银沉淀,不能用于验证稀盐酸是否过量.
(3)氢氧化钙与纯碱反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
故答案为:(1)熟石灰或消石灰;(2)②③;(3)Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
点评 本题难度不大,熟练掌握碱的化学性质、酸的化学性质并能灵活运用是正确解答本题的关键.


科目:初中化学 来源: 题型:填空题
| 原子种类 | 质子数 | 中子数 | 核外电子数 | 相对原子质量 |
| 氢 | 1 | 0 | 1 | 1 |
| 碳 | 6 | 6 | 6 | 12 |
| 氧 | 8 | 8 | 8 | 16 |
| 钠 | 11 | 12 | 11 | 23 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 生铁就是纯净的铁 | |
| B. | 生铁和钢都是混合物 | |
| C. | 钢较软,具有良好的延展性、弹性和机械性能 | |
| D. | 生铁的含碳量低于钢的含碳量 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 除去铁粉中混有的少量银粉 | 用足量的稀盐酸溶解后过滤 |
| B | 除去二氧化碳中的少量一氧化碳 | 通过灼热的氧化铜 |
| C | 证明分子在不断运动 | 将一滴红墨水滴入一杯纯净水中 |
| D | 收集二氧化碳时,检验集气瓶是否集满 | 用一根燃着的木条放在集气瓶口 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 原 子 种 类 | 原子核 | 核 外 电子数 | 相对原 子质量 | |
| 质子数 | 中子数 | |||
| 氢H | 1 | 0 | 1 | 1 |
| 氦He | 2 | 2 | 2 | 4 |
| 氮N | 7 | 7 | 7 | 14 |
| 氧O | 8 | 8 | 8 | 16 |
| 铁Fe | 26 | 30 | 26 | 56 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
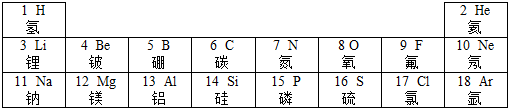
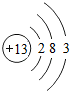 表示的粒子的符号是Al;该元素在元素周期表中处于第三周期.
表示的粒子的符号是Al;该元素在元素周期表中处于第三周期.查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 向20g黄铜(由锌、铜形成的合金)样品中加入10%的稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示.试回答:
向20g黄铜(由锌、铜形成的合金)样品中加入10%的稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示.试回答:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 产物变化情况 | 水浴温度 | ||||||||
| 0℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 70℃ | 80℃ | 90℃ | |
| 试管中蓝色沉淀变化情况 | 短时间内无变化 | 短时间内无变化 | 2分钟后有出现黑色沉淀 | 30秒后出现了黑色物质 | 10秒后出现了黑色物质 | 6秒后出现黑色物质 | 数秒后出现黑色物质 | 马上出现黑色物质 | 蓝色沉淀变黑更快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com