(2012?普陀区一模)①碱石灰是实验室常用的干燥剂,它是氧化钙、氢氧化钠的固体混合物. 除了能吸收水蒸气外,碱石灰还能吸收常见的气体是
C
C
(选填编号,只有一个答案,多选不得分).
A.氧气 B.一氧化碳 C.二氧化碳 D.氢气
②实验室中利用草酸亚铁晶体(FeC
2O
4?2H
2O)受热分解得到一定量的 CO,反应的方程式 为:FeC
2O
4?2H
2O→铁的氧化物+CO+CO
2+2H
2O该反应属于
分解反应
分解反应
(填写基本反应类型),根据质量守恒定律,可以推知产物中“铁的氧化物”的化学式是
FeO
FeO
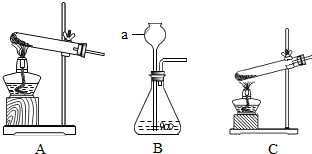
③加热草酸亚铁可选用下列“A、B、C”三套装置中的
A
A
(选填编号“A、B、C”).写出下列仪器“a”的名称是
长颈漏斗
长颈漏斗
.
④草酸亚铁晶体的摩尔质量是
180克/摩尔
180克/摩尔
(写全单位),若有1.8g 草酸亚铁晶体充分反应可得 到CO气体的物质的量是多少?请写出计算过程:
⑤草酸亚铁晶体受热分解得到的气体通过碱石灰后,用来与氧化铜反应,并检验反应得到的气体产物.整套装置如图:
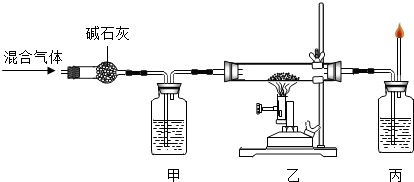
写出“乙”处 反应的 现象是
黑色固体逐渐变红
黑色固体逐渐变红
,反应的 化学方程式 为
,该反应中还原剂是. 甲、丙两处所盛放的试液分别是
澄清石灰水
澄清石灰水
、
澄清石灰水
澄清石灰水
,其中“甲”处所盛放该试液的作用是
检验并除去混合气体中的二氧化碳,以免影响实验结论
检验并除去混合气体中的二氧化碳,以免影响实验结论
.





 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案 (2012?普陀区一模)X、Y、Z 三种固体(均不含结晶水)物质的溶解度曲线如图所示.回答下列问题:
(2012?普陀区一模)X、Y、Z 三种固体(均不含结晶水)物质的溶解度曲线如图所示.回答下列问题:
