某市有座硫酸厂,设备简陋,技术陈旧,该厂每天排放大量含SO2的废气和含H2SO4的酸性废水.当地的其他工厂和居民均用煤炭作燃料.通过对雨水的酸碱度进行测定,发现其pH值小于5.6,得知该雨水属于酸雨,对该地区环境造成极大破坏.
(1)分析该镇下酸雨的原因______
(2)举一例说明酸雨对环境造成的危害______
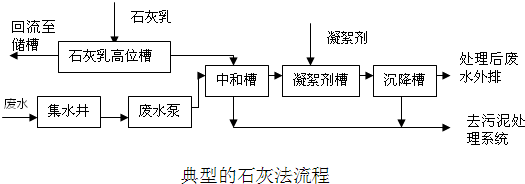
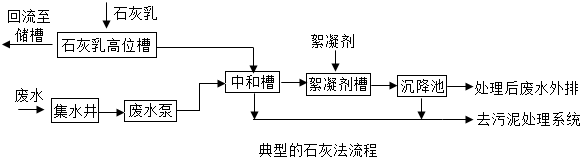
(3)用熟石灰可以处理硫酸厂排出的酸性废水,处理原理的化学方程式是______
(4)汽车排放的尾气(CO、SO2与NO等物质)将会加重空气污染,其治理方法有:在汽车的排气管上装一个“催化转化器”.其作用是使CO和NO反应,生成N2和CO2.写出该反应的化学方程式______ 2CO2+N2
【答案】
分析:(1)二氧化硫溶于水时,能和水反应生成亚硫酸,亚硫酸在一定条件下能够转化成硫酸,当达到一定程度时就形成酸雨;
(2)酸雨会腐蚀建筑,破坏森林;
(3)熟石灰(氢氧化钙)和硫酸反应能生成硫酸钙和水;
(4)根据一氧化碳和一氧化氮经过催化作用生成二氧化碳和氮气进行分析.
解答:解:(1)硫酸厂和居民燃烧煤排放的气体中含SO
2气体,溶于水形成显酸性的雨水,当达到一定程度时就形成酸雨.
故答案为:硫酸厂和居民燃烧煤排放的气体中含SO
2气体,经过复杂的变化,溶于水形成酸雨.
(2)酸雨的危害很大,会腐蚀建筑,破坏森林等.
故答案为:腐蚀建筑.
(3)氢氧化钙和硫酸反应能生成硫酸钙和水,反应的化学方程式为:Ca(OH)
2+H
2SO
4═CaSO
4+2H
2O.
故答案为:Ca(OH)
2+H
2SO
4═CaSO
4+2H
2O.
(4)一氧化碳和一氧化氮在催化剂的条件下生成氮气和二氧化碳,化学反应方程式是:2CO+2NO

2CO
2+N
2.
故答案为:2CO+2NO

2CO
2+N
2.
点评:本题主要考查酸雨的形成和危害,同时考查了化学方程式的书写,书写化学方程式时要遵循质量守恒定律.

 2CO2+N2.
2CO2+N2. 2CO2+N2.
2CO2+N2.