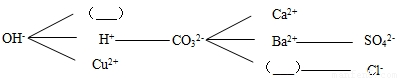
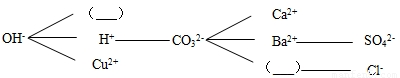
物质间反应常用到两表:金属活动性顺序表,溶解性表.
(1)金属活动性顺序表适用于金属与溶液的反应.某化学探究小组为了验证铁、铜、镁、汞的金属活动性顺序,设计了如下实验方案:
Ⅰ将大小一样的铁片和镁片分别加入到溶质质量分数相同的稀盐酸中;
Ⅱ将铜片加入到硝酸汞溶液中,铜片上出现银白色物质;
Ⅲ将金属片A加入到溶液B中.
①根据实验Ⅰ判断出镁的金属活动性比铁强,依据的现象是;
②根据实验Ⅱ的现象得出的结论是;
③要通过实验Ⅲ得出铁和铜的金属活动性顺序,如果A是铜,则溶液B是;
④查阅资料:金属在活动性顺序里的位置越靠后,其化合物越不稳定,所以它的氧化物越容易被还原.分别以氧化铁和氧化铝为原料,用相同的还原剂还原,更易得到的金属是.
【答案】分析:金属活动性顺序中,只有排在氢前面的金属才能与酸发生置换反应,生成盐和氢气且位置越靠前,反应越剧烈;排在前面的金属能把后面的金属从它的盐溶液中置换出来;由材料可知:金属在活动性顺序里的位置越靠后,其化合物越不稳定,所以它的氧化物越容易被还原,再比较用相同的还原剂更易得到铁和铝中的哪一种时,比较二者的金属活动性顺序即可.
解答:解:只有排在氢前面的金属才能与酸发生置换反应,生成盐和氢气且位置越靠前,反应越剧烈,镁的活动性比铁强,因此镁比铁反应更剧烈;排在前面的金属能把后面的金属从它的盐溶液中置换出来,铜的活动性比汞强,因此铜片加入到硝酸汞溶液中,铜片上出现银白色物质;比较铁与铜的活动性,选择了铜,为了实验现象明显,再选择铁的盐溶液,二者不反应,说明铜的活动性比铁弱;金属在活动性顺序里的位置越靠后,其化合物越不稳定,所以它的氧化物越容易被还原,铝的活动性比铁强,所以,更容易得到的金属是铁.
故答案为:(1)镁比铁反应更剧烈;
(2)铜比汞活动性强;
(3)硫酸亚铁或氯化亚铁;
(4)铁.
点评:金属的活动性顺序的应用主要表现在两个方面:一是只有排在氢前面的金属才能与酸发生置换反应,生成盐和氢气(位置越靠前,反应越剧烈);二是只有排在前面的金属才能把后面的金属从它的盐溶液中置换出来.这是解决此类题目的关键.