
【题目】用化学用语填空。
(1)镁元素______;
(2)2个氢分子________;
(3)氧化钾______;
(4)标出NO3-中氮元素的化合价______。
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:初中化学 来源: 题型:
【题目】A、B、C三种固体物质的溶解度曲线如图所示,请你回答下列相关问题
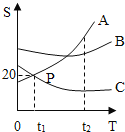
(1)P点表示的意义是_____;
(2)将A从含有少量B物质的混合物中提纯出来的方法是_____;
(3)欲使t2℃时A物质的饱和溶液变为不饱和溶液,可采取_____(任填一种方法)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】了解物质构成的奥秘,能帮助我们更好的认识物质变化的本质。下列是几种粒子的结构示意图,有关它们的叙述,正确的是
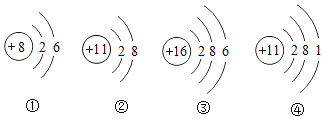
A.①②③④表示的是四种不同元素
B.②表示的是阴离子
C.④表示的元素在形成化合物时化合价为-1 价
D.①③所表示的粒子化学性质相似
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2018年5月18日我国第一艘国产航母海试成功,航母的许多电子元件使用了黄铜。为测定某黄铜(假设合金中仅含铜和锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀硫酸的质量(g) | 20 | 20 | 20 | 20 |
烧杯中剩余物的质量(g) | 39.92 | 59.84 | 79.80 | 99.80 |
(1)黄铜粉末完全反应生成氢气的总质量为__g。
(2)第三次实验后溶液中的溶质是___。
(3)该黄铜中铜的质量分数为多少__?(写 出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是宝贵的自然资料,让我们一起走进“水”的世界。
(1)“直饮水机”可将自来水净化为饮用水,其内部使用的活性炭主要起_________作用,生活中常用_____________检验饮用水是硬水还是软水。
(2)C1O2是饮用水常用的消毒剂,制取C1O2的化学方程式为:C12+2NaC1O2=2C1O2+2X,X的化学式__________。
(3)下图为电解水的实验装置图。通电一段时间后,玻璃管b中收集到的气体是______,该实验说明水是由_________组成的。
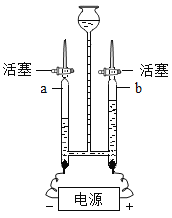
(4)爱护水资源,一方面要__________,另一方面要防治水体污染。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为实验室常用装置。
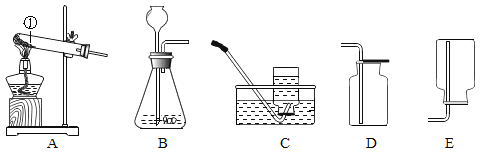
(1)仪器①的名称是_______。
(2)实验室用高锰酸钾制取氧气应选择的发生装置是_____(填字母),反应的化学方程式为_______。应对该装置进行的改进是_______。
(3)已知氯化铵和熟石灰固体混合共热,可制取易溶于水的氨气(NH3 )。用该法制NH3时,应选择的发生装置是____(填字母),收集装置是____(填字母)。
(4)如图所示,用制得的二氧化碳完成如图实验。可观察到______中的石蕊小花变红(填序号)。由该实验可以得出酸的一条化学性质是_____。.

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B 、C、D、E是初中常见的五种不同的物质。D是一种红色固体单质,C、D、E都含有同种金属元素,A是胃酸的主要成分,且与B反应生成白色沉淀。“一”表示两物质间相互能反应,“→”表示一种物质可直接生成另一种物质。回答下列问题:
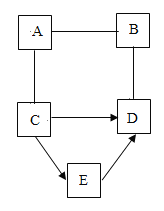
(1)C的化学式为_____。
(2)A-B的反应实质是_____。
(3)E→D的化学反应方程式是_____。
(4)B-D能发生反应的原因:_____。
(5)A物质的一种用途_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】地球深处的水处于超临界状态称为超临界水。如图为某压强下CaCl2和NaCl在超临界水中的溶解度曲线,在这种状态下,下列有关说法正确的是
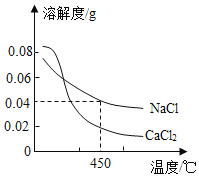
A.NaCl的溶解度大于CaCl2的溶解度
B.450°C时可得到0.04%的NaCl溶液
C.可用降温结晶的方法得到CaCl2晶体
D.升温可使CaCl2的不饱和溶液变为饱和溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了探究金属性质,某实验小组进行了如下实验:
(1)探究金属与酸反应的规律,某实验小组进行了如下实验:取等质量、同形状的铁片镁片、锌片,分别与等体积、等浓度的稀盐酸反应,用温度传感器测得反应温度变化曲线如图所示。
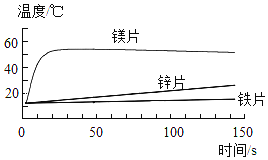
①请分析反应中温度升高的原因:_______。
②根据曲线总结出金属活动性的相关规律_______。
(2)探究金属与某些盐溶液反应的规律,实验如下:向一定量的硝酸银和硝酸铜混合溶液中逐渐加入锌粉。绘制的溶液中溶质种类与加入锌的质量关系如图所示。
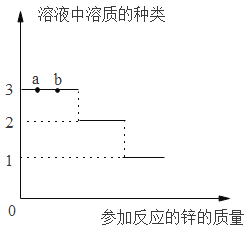
①向滤液中插入铁丝,铁丝表面无明显变化,过滤后滤渣中的成分有______。
②a、b两点,溶液的质量a____b(填“=”、“<”或“>”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com