
【题目】如图为甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是
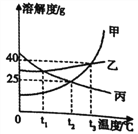
A. 若乙中含有少量甲,可采用冷却热饱和溶液的方法提纯乙
B. 当t1℃< t<t2℃时,丙溶液的质量分数大于甲溶液
C. 甲、乙、丙三种物质的饱和溶液从t1℃升温至t3℃,所得溶液的质量分数关系是甲=乙>丙
D. 将t3℃时甲、乙、丙三种物质的饱和溶液各恒温蒸发10g水,析出固体质量的关系是甲=乙>丙
【答案】D
【解析】A、乙的溶解度随温度的变化不大,乙中含有少量甲,可采用蒸发结晶的方法提纯乙,错误;B、不知溶液是否饱和,也不知溶质、溶剂的质量多少,无法判断溶质的质量分数大小,错误;C、将t3℃时等质量的甲、乙、丙三种物质的饱和溶液同时降温到t1℃,丙的溶质质量分数不变,甲和乙的都有晶体析出,溶质质量分数会减小,根据图象可以看出,在t1℃时甲、乙、丙三种物质的溶解度是乙=丙>甲,甲、乙、丙三种物质的饱和溶液从t1℃升温至t3℃,丙的溶解度减小,丙溶解的质量仍大于甲,故从t1℃升温至t3℃时,所得溶液的质量分数关系是乙>丙>甲,错误;D、将t3℃时甲、乙、丙三种物质的饱和溶液各恒温蒸发10g水,甲和乙析出的晶体质量相等,故析出固体质量的关系是甲=乙>丙,正确。故选D。


科目:初中化学 来源: 题型:
【题目】将27 g铝粉、56 g铁粉分别与等质量、等质量分数的稀硫酸充分反应,生成氢气的质量与反应时间的关系如右图。下列叙述与该曲线图相符的是
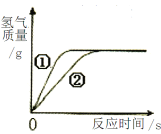
A.①表示铁粉与稀硫酸反应的情况
B.反应结束,铝、铁均完全反应,硫酸有剩余
C.反应结束,硫酸完全反应,铝、铁均有剩余
D.反应结束,硫酸、铁均完全反应,铝有剩余
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】海水晒盐能够得到粗盐和卤水。卤水中含有MgCl2、KCl和MgSO4等物质,下图是它们的溶解度曲线。完成下列填空。
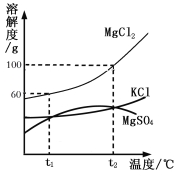
(1)在t1℃时,向100 g水中加入150 g MgCl2,形成 (填“饱和”或“不饱和”)溶液,将其温度升高到t2℃时,此时溶液中溶质的质量分数为 。
(2)t1℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液中,溶质质量分数最大的是 。将t2℃时MgCl2、KCl和MgSO4三种物质的饱和溶液降温至t1℃时,可能会析出的晶体有 (填字母序号)。
A.MgCl2和KCl B.只有MgSO4 C.MgCl2、KCl和MgSO4
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是某药厂生产的一种抗酸药(治疗胃酸过多的药物)的说明书的部分内容.阅读后回答下列问题.
说明书
主要成分:碳酸氢钠(NaHCO3)
适 应 症:用于缓解胃酸(含有
盐酸)过多引起的胃痛
用 法:嚼碎后服用
规 格:2.5g/片
注意事项:胃溃疡患者慎服
现取4片药片碾碎后,加到烧杯中,再往烧杯中加入60g稀盐酸,完全反应后,烧杯中物质的总质量为65.6g,(药品的其它成分不溶于水,也不参加反应),求:
(1)生成二氧化碳的质量是___________.
(2)此药片中碳酸氢钠的质量分数是__________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】天然气作为燃料已进入千家万户,天然气属于_____(可再生或不可再生)能源,天然气主要成分甲烷在空气中完全燃烧生成水和二氧化碳。如果它不完全燃烧会生成什么物质呢?某研究性学习小组对此展开探究:
【提出猜想】生成物中一定有H2O,可能有CO2和CO。
【实验探究】该小组同学将燃烧生成的混合气体依次通过如图所示装置,验证猜想。
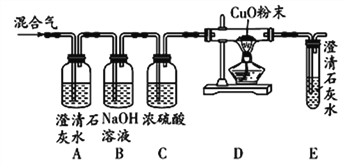
【现象与结论】
(1)观察到A中__________,证明混合气体中有CO2。
(2)C中浓硫酸的作用是________。
(3)观察到D中粉末由黑色变成红色,证明混合气体中有CO,该反应的化学方程式为_________。
【交流与讨论】
(4)小武认为:从E装置中澄清石灰水变浑浊也能推断出混合气体中有一氧化碳。那么B中NaOH溶液的作用是______,发生反应的方程式是________。为了得到更可靠的结论,同学们建议在B、C之间连接一个与A相同的装置,则该装置的作用是________。
(5)小文则提出:从环保的角度看,此装置有一个不足之处,你认为是_______。
【解释与应用】
(6)日常生活中厨房里的燃气不完全燃烧也会产生CO,人吸入较多CO会发生中毒,中毒的原理是CO与人体血液中_______结合使它失去输氧功能,因此厨房里要注意经常开窗通风透气,防止发生中毒事故。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某种矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,用它制备氢氧化镁的流程示意图如图所示(已知:二氧化硅不溶于水也不与稀盐酸反应)。
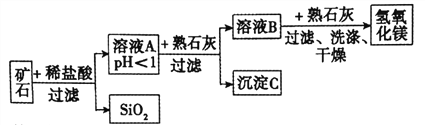
请回答下列问题。
(1)加稀盐酸之前要将矿石粉碎的目的是_____________。
(2)溶液A中除了Mg2+外,还含有的金属阳离子是______________;(写离子符号)
写出矿石中的任意一种金属氧化物与稀盐酸反应的化学方程式:______________(只写一个)。
(3)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子逐步转化为沉淀。该实验条件下,使金属阳离子沉淀的相关pH数据见下表。为保证产品纯度、减少产品损失,并便于操作,所得溶液B的pH的取值范围为______________。(用不等式表示)
氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀的pH | 1.5 | 4.2 | 8.6 |
完全沉淀的pH | 3.2 | 6.7 | 11.1 |
(4)写出溶液B中加入熟石灰发生反应的化学方程式:___________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组的同学做粗盐提纯实验,如图是同学们做粗盐提纯实验的示意图。
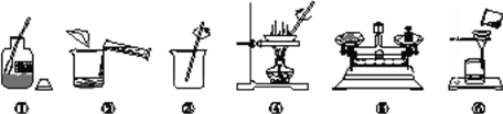
请回答下列问题。
(1)操作③中玻璃棒搅拌的作用是____________。
(2)操作⑥中的错误是___________。
(3)粗盐提纯实验中操作顺序为①⑤②_______(填操作序号),以及称量精盐并计算产率。
(4)操作④中,当观察到蒸发皿内____________时,停止加热,让余热蒸干剩余液体。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】CuCl2是一种广泛用于生产颜料、木材防腐剂等的化工产品。工业上以辉铜矿(主要含有Cu2S、Fe2O3及一些不溶性杂质)为原料制备CuCl22H2O晶体的工艺流程如下:

请回答下列问题:
(1)焙烧中生成黑色固体,反应的化学方程式为_______________________。
(2)酸浸时发生的化学方程式为___________________(写出一种),为加快反应速率,以下措施无法达到目的是_________________。
A.延长酸浸时间 B.将辉铜矿粉碎 C.适当增加盐酸浓度
(3)色光度是产品质量指标之一,合格CuCl22H2O晶体的色光度范围为-0.5~0.5,反应过程溶液pH对产率、色光度的影响如图2所示,综合考虑制备时应控制pH的较合理范围是____________。
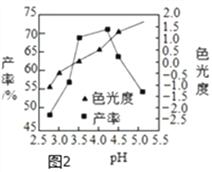
(4)CuCl22H2O晶体可用氯化铜饱和溶液洗涤而不用蒸馏水的原因是_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请将下列短文中带点的部分,用恰当的化学用语填写在横线上:
“南澳一号”考古发掘出青花瓷、青铜器、铁器等文物。青花瓷上的着色剂是氧化钴(CoO),氧化钴中钴元素的化合价显+2价_______;青铜器文物上的铜绿含有碳元素_______,铜绿可以用酸洗掉,清洗后的溶液中含有n个铜离子_____和很多硫酸根离子_______;铁质文物上的铁锈主要成分是氧化铁________;这些文物在博物馆往往把它们放到氦的环境中保存,氦气的化学式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com