
相关资料:
(一)盐酸是一种挥发性的酸,它会发出的氯化氢气体是一种易溶于水的气体.氯化氢溶于水既得盐酸;盐酸的挥发性随其溶质的质量分数减小而减弱.盐酸和醋酸一样能使紫色的石蕊试液变成红色.
(二)硫酸钙微溶于水.石灰石与稀硫酸反应,生成的硫酸钙会覆盖在石灰石表面,阻碍反应的继续发生.
请你和小明仪器进行实验室制取二氧化碳的探究.
(1)选择药品.小明对三组药品进行了实验研究,实验记录如下:
| 组别 | 药品 | 实验现象 |
| ① | 块状石灰石和稀盐酸 | 产生气泡速率适中 |
| ② | 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
| ③ | 碳酸钙粉末和稀盐酸 | 产生气泡速率很快 |
从制取和收集的角度分析,一般选择第①组药品,该组药品发生反应的化学方程式为 _________ ;不选择第③组药品的原因是 _________ .
(2)选择装置.通过对制取氧气装置的分析,他选择用过氧化氢制取氧气的发生装置.你认为他选择的依据是 _________ .
(3)制取气体.将药品装入所选装置制取气体,并用向上排空气法收集.验满方法是 _________ .
(4)气体检验.将生成的气体通入石蕊溶液中,溶液变红,因此他确定该气体是二氧化碳.他的检验方法是否正确?请说明理由. _________ .
(10分)相关资料:
(一)盐酸是一种挥发性的酸,它会发出的氯化氢气体是一种易溶于水的气体.氯化氢溶于水既得盐酸;盐酸的挥发性随其溶质的质量分数减小而减弱.盐酸和醋酸一样能使紫色的石蕊试液变成红色.
(二)硫酸钙微溶于水.石灰石与稀硫酸反应,生成的硫酸钙会覆盖在石灰石表面,阻碍反应的继续发生.
请你和小明仪器进行实验室制取二氧化碳的探究.
(1)选择药品.小明对三组药品进行了实验研究,实验记录如下:
| 组别 | 药品 | 实验现象 |
| ① | 块状石灰石和稀盐酸 | 产生气泡速率适中 |
| ② | 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
| ③ | 碳酸钙粉末和稀盐酸 | 产生气泡速率很快 |
从制取和收集的角度分析,一般选择第①组药品,该组药品发生反应的化学方程式为 CaCO3+2HCl=CaCl2+H2O+CO2↑ ;不选择第③组药品的原因是 反应太快,不便于收集 .
(2)选择装置.通过对制取氧气装置的分析,他选择用过氧化氢制取氧气的发生装置.你认为他选择的依据是 操作简便,不需加热,安全. .
(3)制取气体.将药品装入所选装置制取气体,并用向上排空气法收集.验满方法是 将燃烧的木条放在集气瓶口,观察木条是否熄灭 .
(4)气体检验.将生成的气体通入石蕊溶液中,溶液变红,因此他确定该气体是二氧化碳.他的检验方法是否正确?请说明理由. 不正确,因为其他气体如“氯化氢”也能使石蕊溶液变红 .
| 解答: | 解:(1)回忆二氧化碳的反应装置和反应原理:制取二氧化碳使用固体+液体反应,不需加热;化学反应式是:CaCO3+2HCl═CaCl2+CO2↑+H2O,第③组药品反应速率太快,不便于收集. (2)回忆用过氧化氢与二氧化锰支取氧气的反应装置和反应原理:制取氧气使用过氧化氢溶液:固体+液体反应,不需加热;操作简便安全 (3)学会区别二氧化碳和氧气的验满方法.二氧化碳验满的方法是:燃着的木条放在集气瓶口,观察火焰是否熄灭; (4)二氧化碳的检验方法只是:能否使澄清石灰水变浑浊;将生成的气体通入紫色石蕊试液中,溶液变红,因此他确定该气体是二氧化碳,是不正确的,因为生成气体中可能混有HCl气体,也能使紫色石蕊试液变红. 故答案为: (1)CaCO3+2HCl═CaCl2+CO2↑+H2O; 反应速率太快,不便于收集. (2)操作简便,不需加热,安全. (3)燃着的木条放在集气瓶口,观察火焰是否熄灭. (4)不正确,生成气体中可能混有HCl气体,也能使紫色石蕊试液变红(或应该用澄清的石灰水检验二氧化碳). |


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:阅读理解
 29、夏天到了,衣服上常会留下难以清洗的汗渍、果汁渍等.现在市场上出售一种“污渍爆炸盐”,宣称“含天然活性氧,能在瞬间去除洗衣粉难以除去的多种顽固污渍”.
29、夏天到了,衣服上常会留下难以清洗的汗渍、果汁渍等.现在市场上出售一种“污渍爆炸盐”,宣称“含天然活性氧,能在瞬间去除洗衣粉难以除去的多种顽固污渍”.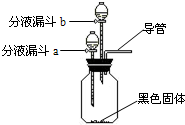
| 序号 | 主要操作步骤 | 主要实验现象 | 操作目的 |
| ① | 在集气瓶中加入少量MnO2(黑色固体);在分液漏斗a中加入新配制的“污渍爆炸盐”的饱和水溶液;在分液漏斗b中加入 稀盐酸 . |
||
| ② | 打开分液漏斗a的活塞,放出适量溶液后,关闭活塞. | 生成大量无色气体. | |
| 然后 用带火星的木条接近导管口 . |
带火星的木条复燃 . |
验证生成气体的成分. | |
| 第②步操作得到的结论: “污渍爆炸盐”溶于水生成过氧化氢 . | |||
| ③ | 待②步反应停止后,打开分液漏斗b的活塞,放出适量溶液后,关闭活塞. | 生成大量无色气体. | |
| 将生成的气体通入 澄清石灰水 . |
澄清石灰水变浑浊 . |
验证生成气体的成分. | |
| 第③步操作得到的结论: “污渍爆炸盐”溶于水生成碳酸钠(或碳酸盐) . | |||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
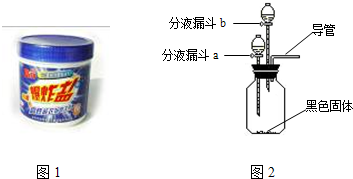
| 序号 | 主要操作步骤 | 主要实验现象 | 化学反应方程式 | |
| ① | 在集气瓶中加入少量 |
|||
| ② | 打开分液漏斗a的活塞,放出适量溶液后,关闭活塞. | 生成大量无色气体. | ||
| 然后 |
||||
| 第②步操作得到的结论:“污渍爆炸盐”溶于水生成过氧化氢 | ||||
| ③ | 待②步反应停止后,打开分液漏斗b的活塞,放出适量溶液后,关闭活塞. | 生成大量无色气体. | ||
| 将生成的气体通入 |
验证生成气体的成分. | |||
| 第③步操作得到的结论:“污渍爆炸盐”溶于水生成碳酸钠 | ||||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 阴离子 阳离子 |
OH- | Cl- | CO32- | HCO3- |
| H+ | 溶、挥 | 溶、挥 | 溶、挥 | |
| Ca2+ | 微 | 溶 | 不 | 溶 |
| Ba2+ | 溶 | 溶 | 不 | 溶 |
| 实验步骤 | 实验操作 | 实验中可能出现的现象 | 相应结论 |
| 一 | 向A的试样中加入足量的水 | ①A的试样全部溶解 | A是 Na2CO3和NaHCO3 Na2CO3和NaHCO3 |
| ②A的试样部分溶解 | A是 Na2CO3和CaCO3或NaHCO3和CaCO3 Na2CO3和CaCO3或NaHCO3和CaCO3 | ||
| 二 | 若A的试样部分溶解则向其滤液中加入 酚酞试液 酚酞试液 |
③ 溶液显红色 溶液显红色 |
A是 Na2CO3和CaCO3 Na2CO3和CaCO3 |
| ④ 溶液显浅红色 溶液显浅红色 |
A是 NaHCO3和CaCO3 NaHCO3和CaCO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验操作 | 实验现象 | 结论 |
| 用试管取该溶液1-2ml,滴入1-2ml滴无色酚酞试液,振荡 | 无色酚酞试液变 红 红 |
溶液呈碱性 |
| 无色酚酞试液不变色 | 溶液呈 酸性或中性 酸性或中性 |
查看答案和解析>>
科目:初中化学 来源: 题型:
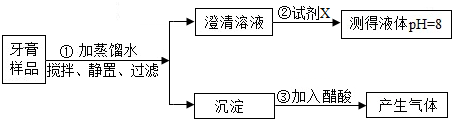
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com