
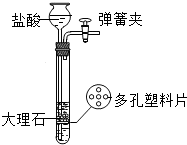
 如图是实验室制备CO2的装置,下列四个装置中,不能控制反应的发生和停止效果的是( )
如图是实验室制备CO2的装置,下列四个装置中,不能控制反应的发生和停止效果的是( )A、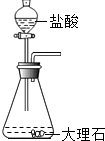 |
B、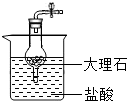 |
C、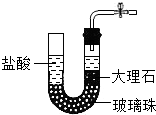 |
D、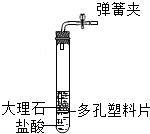 |


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
 如图是水电解实验示意图:
如图是水电解实验示意图:查看答案和解析>>
科目:初中化学 来源: 题型:
| A、赤铁矿(主要成分是Fe2O3) |
| B、黄铁矿(主要成分是Fe2S) |
| C、磁铁矿(主要成分是Fe3O4) |
| D、赤铜矿(主要成分是Cu2O) |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、NaCl Ca(OH)2 Na2CO3 |
| B、KNO3 HCl BaCl2 |
| C、HCl FeCl3 NaNO3 |
| D、NaOH HNO3 Na2SO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、溶质质量:溶剂质量=1:4 |
| B、溶质质量:溶液质量=1:5 |
| C、溶剂质量:溶液质量=5:6 |
| D、溶液质量:溶质质量=4:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:
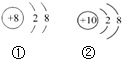
| A、它们属于同种原子形成的微粒 |
| B、它们的核外电子层数相同 |
| C、它们的核外电子数相同 |
| D、①表示阴离子,②表示原子 |
查看答案和解析>>
科目:初中化学 来源: 题型:
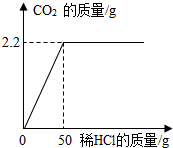 为测定某石灰石样品中碳酸钙的含量,取该石灰石样品10g放入烧杯中,加入一定溶质质量分数的稀盐酸使之充分反应,所加稀盐酸质量与生成的二氧化碳质量关系如图所示.求:
为测定某石灰石样品中碳酸钙的含量,取该石灰石样品10g放入烧杯中,加入一定溶质质量分数的稀盐酸使之充分反应,所加稀盐酸质量与生成的二氧化碳质量关系如图所示.求:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com