
| A. | 人类使用铝的年代早于金属铜、铁 | |
| B. | 金(Au)高温条件下也很难与氧气反应 | |
| C. | 通过工业高炉炼铁得到纯净金属铁 | |
| D. | 武德合金熔点高,可用于制造保险丝 |
科目:初中化学 来源: 题型:解答题
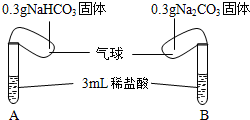 碳酸钠、碳酸氢钠是中学常见的化合物.
碳酸钠、碳酸氢钠是中学常见的化合物.| 步骤① | 步骤② | 步骤③ | 步骤④ | 步骤⑤ |
| 测量10mL水温/℃ | 加入物质0.5g | 溶解后测量溶液温度t1/℃ | 静置一段时间后测量溶液温度t2/℃ | 加入20%盐酸10mL反应后测量溶液温度t3/℃ |
| 20 | NaHCO3 | 18.5 | 20.0 | 20.8 |
| 20 | Na2CO3 | 23.3 | 20.0 | 23.7 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Mn | B. | H | C. | O | D. | Cl |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 转移称好的氯化钠固体时,有少量洒在桌上 | |
| B. | 称取氯化钠固体质量偏大 | |
| C. | 转移配好的氯化钠溶液时,有少量液体溅出 | |
| D. | 量取稀释用的水体积偏小 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com