
 如图为A、B、C三种物质的溶解度曲线,请据图判断下列叙述中不正确的是( )
如图为A、B、C三种物质的溶解度曲线,请据图判断下列叙述中不正确的是( )| A. | t1℃时,将40克B物质溶解在60克水中,溶质的质量分数为40% | |
| B. | t2℃时,三种物质的溶解度由大到小的顺序为:A>B>C | |
| C. | 要将C的不饱和溶液转化为饱和溶液可以采取升温的方法 | |
| D. | 要使A从其浓溶液中析出,可采用冷却热饱和溶液法 |
分析 A、据该物质下物质的溶解度及饱和溶液中溶质的质量分数分析解答;
B、据溶解度曲线可比较同一温度下不同物质的溶解度大小;
C、C的溶解度随温度升高而减小,所以其不饱和溶液变为饱和溶液可采取升温的方法;
D、A的溶解度随温度升高而增大,所以要使其从浓溶液中析出可采取冷却热饱和溶液的方法.
解答 解:A、t1℃时B的溶解度是40g,即100g水中最多溶解40g的B,所以将40克B物质溶解在60克水中不能全部溶解,饱和溶液中溶质的质量分数=$\frac{溶解度}{溶解度+100g}$×100%,其溶质的质量分数=$\frac{40g}{140g}$×100%<40%,故错误;
B、t2℃时,三种物质的溶解度由大到小的顺序为:A>B>C,正确;
C、C的溶解度随温度升高而减小,所以其不饱和溶液变为饱和溶液可采取升温的方法,正确;
D、A的溶解度随温度升高而增大,所以要使其从浓溶液中析出可采取冷却热饱和溶液的方法,正确;
故选:A.
点评 掌握饱和溶液中溶质的质量分数的计算方法、溶解度曲线的意义等知识,并会应用知识解决相关问题.


科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氢氧化钠易溶于水 | B. | 氢氧化钠易潮解、变质 | ||
| C. | 氢氧化钠易挥发 | D. | 氢氧化钠溶于水会放出大量的热 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
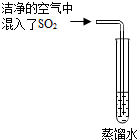 雨、雪在形成和降落过程中可吸收、溶解空气中SO2及氮氧化物等物质,形成了pH小于5.6的降水称为酸雨.请回答下列有关酸雨的问题:
雨、雪在形成和降落过程中可吸收、溶解空气中SO2及氮氧化物等物质,形成了pH小于5.6的降水称为酸雨.请回答下列有关酸雨的问题:| 实验序号 | X的用量/g | Y的用量/g | 生成X2Y的质量/g |
| 1 | 6.4 | 1.8 | 7.2 |
| 2 | 9 | 3.6 | 12.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氢氧化钠食盐NaCl | B. | 氧化钙消石灰CaO | ||
| C. | 氧化钠苛性钠NaOH | D. | 碳酸钠纯碱 Na2CO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 可用生石灰和水反应制得 | B. | 其钙元素的化合价为+l价 | ||
| C. | 可与CO2反应 | D. | 使紫色石蕊试液变蓝色 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
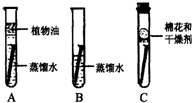 2011年3月22日是第二十三个“世界水日”,今年“世界水日”的主题是“应对水短缺”.请回答下列有关问题:
2011年3月22日是第二十三个“世界水日”,今年“世界水日”的主题是“应对水短缺”.请回答下列有关问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com