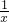含0.1摩尔NaOH的氢氧化钠溶液40克与一定质量的稀盐酸恰好完全反应.
求:(1)该氢氧化钠溶液的质量分数是多少?
(2)稀盐酸中含HCl的物质的量是多少?(根据化学方程式计算)
解:(1)0.1摩尔NaOH的氢氧化钠为:0.1mol×40g/mol=4g
所以该氢氧化钠溶液的质量分数为:
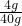
×100%=10%
(2)设盐酸中含HCl的物质的量为x
NaOH+HCl═NaCl+H
2O
1 1
0.1mol x
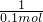
=
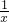
解得:x=0.1mol
答:稀盐酸中含HCl的物质的量是0.1mol.
故答案为:(1)10%;
(2)0.1mol.
分析:(1)根据溶液中氢氧化钠的物质的量可以计算出氢氧化钠的质量,然后根据溶液中溶质的质量分数的计算方法可以求出氢氧化钠溶液的质量分数;
(2)根据氢氧化钠的物质的量结合反应的化学方程式可以计算出稀盐酸中HCl的物质的量,
点评:本题主要考查学生利用化学方程式和溶质质量分数公式进行计算的能力.解题的关键是分析物质之间的反应情况,确定反应的化学方程式;弄清楚溶质质量和溶液质量的计算方法.

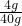 ×100%=10%
×100%=10%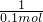 =
=