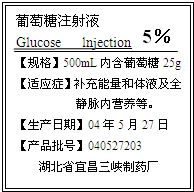
(1)、现需配制1000mL密度为1.07g/mL 10%的稀硫酸,需密度为1.84 g/mL98%的浓硫酸多少毫升?需水多少毫升?如何配制?(2)、13 g锌与上述稀硫酸充分反应,理论上可制得氢气多少克?
【答案】分析:(1)根据稀释前后溶液中溶质质量不变,计算需要浓硫酸和水的体积,并简述配制过程;
(2)根据化学方程式,选择正确的数据计算生成氢气的质量.
解答:解:(1)设需要98%的浓硫酸的体积为x
1000mL×1.07g/mL×10%=x×1.84g/mL×98%
解之得 x≈59.34mL
则需要水的质量=1000mL×1.07g/mL-59.34mL×1.84g/mL=960.8g(合960.8mL)
答:需密度为1.84 g/mL98%的浓硫酸59.34毫升,需水960.8毫升.配制方法:用1000mL量筒量取960.8mL水倒入烧杯,再用100mL量筒量取98%的浓硫酸59.3mL沿烧杯壁慢慢倒入盛有水的烧杯中,并不断用玻璃棒搅拌,直到混合均匀.
(2)设13g完全反应需要消耗硫酸的质量为y,同时生成氢气质量为z
Zn+H2SO4=ZnSO4+H2↑
65 98 2
13g y z
65:2=13g:z
解之得 z=0.4g
65:98=13g:y
解之得 y=19.6g
∵19.6g<1000mL×1.07g/mL×10%
∴硫酸过量,13g锌完全反应
答:13 g锌与上述稀硫酸充分反应,理论上可制得氢气0.4g.
点评:根据化学方程式由反应物的质量计算生成物质量时,要根据完全反应的反应物的质量进行计算.



 18、(1)2004年春,轰动全国的安徽阜阳市劣质奶粉事件,导致出现200名“大头婴儿”和10多名婴儿夭亡.经检测,劣质奶粉几乎不含
18、(1)2004年春,轰动全国的安徽阜阳市劣质奶粉事件,导致出现200名“大头婴儿”和10多名婴儿夭亡.经检测,劣质奶粉几乎不含