
 石灰石是一种常见的建筑材料,在生产生活中应用广泛.在实验室中,常用石灰石与稀盐酸反应制备二氧化碳气体.
石灰石是一种常见的建筑材料,在生产生活中应用广泛.在实验室中,常用石灰石与稀盐酸反应制备二氧化碳气体.分析 (1)由于提示废液中含有剩余的少量盐酸,所以加入碳酸钠应该是先和盐酸反应,后和氯化钙反应.分析对应的现象;
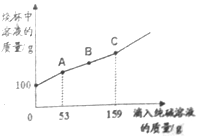
(2)根据图中曲线变化情况,起始阶段应为碳酸钠和盐酸反应,AC段为碳酸钠和氯化钙反应,C之后没有反应发生,进而进行分析;
解答 解:
(1)由于提示废液中含有剩余的少量盐酸,所以加入碳酸钠应该是先和盐酸反应,后和氯化钙反应.所以对应的现象是开始时有无色气体生成,后有白色沉淀产生.
(2)据图中曲线变化情况,起始阶段应为碳酸钠和盐酸反应,AC段为碳酸钠和氯化钙反应,C之后没有反应发生.
①由图可知,实验过程中与稀盐酸反应而消耗的碳酸钠的质量为 53g;
②图中B点所对应烧杯中的溶液里,此阶段为碳酸钠和氯化钙反应,此时氯化钙尚未完全反应,所以所含溶质为生成的氯化钠和剩余的氯化钙,对弈的化学式为 NaCl和CaCl2;
③由图可知和氯化钙反应的碳酸钠溶液的质量为159g-53g=106g,其中所含溶质的质量为106g×10%=10.6g.
设此废液中所含CaCl2的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 111
10.6g x
$\frac{106}{111}$=$\frac{10.6g}{x}$
x=11.1g
答:(1)实验室制取二氧化碳后的剩余废液中常含有少量盐酸,如果将足量纯碱溶液逐渐滴入到上述废液中,可以观察到的明显实验现象有 开始时有无色气体生成,后有白色沉淀产生;
(2)①由图可知,实验过程中与稀盐酸反应而消耗的碳酸钠的质量为 53g;
②图中B点所对应烧杯中的溶液里,所含溶质为 NaCl和CaCl2;
③通过化学方程式可得此废液中所含CaCl2的质量11.1g.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.


科目:初中化学 来源: 题型:选择题
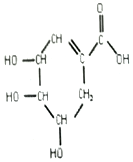 莽草酸是从中药八角茴香中提取的一种化合物,是生产抗甲流药物“达菲”的主要原料,其结构如图所示,下列关于莽草酸的叙述错误的是( )
莽草酸是从中药八角茴香中提取的一种化合物,是生产抗甲流药物“达菲”的主要原料,其结构如图所示,下列关于莽草酸的叙述错误的是( )| A. | 莽草酸分子构成的莽草酸中含有碳、氢、氧三种元素 | |
| B. | 莽草酸由碳、氢、氧原子构成 | |
| C. | 莽草酸是由多原子分子构成的有机化合物 | |
| D. | 莽草酸分子中氢、氧元素的原子质量比为1:8 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 2个一氧化碳分子──2CO | B. | 结构示意图为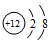 的粒子:Mg2+ 的粒子:Mg2+ | ||
| C. | FeCl2中Fe元素的化合价:$\stackrel{+2}{Fe}$Cl2 | D. | 2个氢原子:H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com