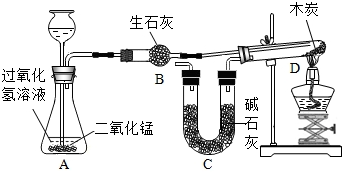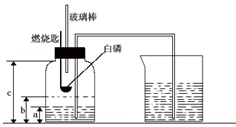
某校化学研究性学习小组在学习了“空气中氧气含量测定”的基础上,改进了教材中的实验,设计出了如图所示的实验装置.实验步骤如下:
①如图所示,连接仪器,检查装置的气密性.发现装置的气密性良好.
②在集气瓶里装进适量a 体积的水,燃烧匙里放一块白磷(其着火点是40℃),并在酒精灯上把玻璃棒下端加热,按图示装置把集气瓶中的空气密封起来,把长导管的另一端放入盛有足量水的烧杯中.(注:集气瓶内的长导管已伸到了瓶底)
③用力把预先加热过的玻璃棒按下与白磷接触,观察到白磷立即着火燃烧,产生大量白烟,同时放出大量的热.(注:白磷与红磷燃烧的产物相同)
④待白磷燃烧熄灭后,稍加振荡,白烟消失.
⑤待集气瓶完全冷却至室温,量出集气瓶中水的体积是b,整个集气瓶的体积是c.
⑥根据a、b、c三个数据,计算出空气中氧气的体积分数.
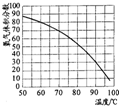
根据以上信息,回答下列问题.
(1)在白磷开始燃烧到最后熄灭的过程中,集气瓶内水面的变化情况是
先下降后上升
先下降后上升
.
(2)若实验非常成功,请写出a、b、c三个数据应满足的一个等式关系式:
.
(3)组内成员小葛为了证明实验完成后的集气瓶内是否还有氧气剩余,他没有利用其它的仪器和药品,仍是利用了上述实验涉及的仪器和药品,设计了一个实验,最后得出了瓶内一定没有氧气剩余的结论.你知道他是如何实验的吗?写出简要的实验步骤和实验现象.
(4)组内成员小张对“实验前集气瓶里要装进适量a 体积的水”非常不理解.咨询了组长小明之后,他终于明白“a 体积的水”的作用,其一是为了加快⑤步骤中集气瓶的冷却速度;其二则主要是
形成液封,防止实验过程中集气瓶内的气体从长导管中向外逸散而影响实验结果
形成液封,防止实验过程中集气瓶内的气体从长导管中向外逸散而影响实验结果
.
(5)组内成员小杭性格好动,无意间他发现向⑤步骤集气瓶内的水中滴加几滴紫色石蕊试液,水会变红.这一现象使组内成员积极地展开了讨论,成员小葛是由于二氧化碳溶于水,使溶液显酸性而导致的,但小明马上作出反对,原因是空气中二氧化碳的含量极少,而实验过程中又没有产生二氧化碳,短时间内不可能会使溶液显酸性.你认为谁的观点正确?
小明
小明
.若你认为小明的观点正确,那么请你对“变红”现象提出大胆地猜想:
白烟(五氧化二磷固体)溶于水中形成了酸性物质
白烟(五氧化二磷固体)溶于水中形成了酸性物质
.(若你认为小葛的观点正确,此空不填)
(6)在上述实验中,下列操作的实施和实验现象的出现,会导致实验最后产生的实际值大于理论值的是
B
B
A.装置气密性不好 B.实验前集气瓶里没有装a 体积的水
C.集气瓶没有冷却到室温 D.用红磷代替白磷(红磷的着火点在240℃左右)

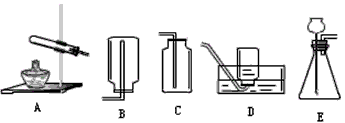
 用如图所示装置测定某铁的氧化物中铁元素和氧元素的质量比,记录如下:
用如图所示装置测定某铁的氧化物中铁元素和氧元素的质量比,记录如下:
 某校化学研究性学习小组在学习了“空气中氧气含量测定”的基础上,改进了教材中的实验,设计出了如图所示的实验装置.实验步骤如下:
某校化学研究性学习小组在学习了“空气中氧气含量测定”的基础上,改进了教材中的实验,设计出了如图所示的实验装置.实验步骤如下: