
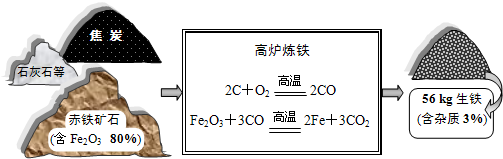
| ||
| 160 |
| 112 |
| x×80% |
| 56kg×(1-3%) |
| ||
| 160 |
| 112 |
| x×80% |
| 56kg×(1-3%) |
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:022
(2005
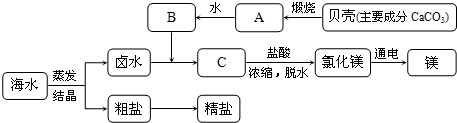
年济南)海水的综合利用可以制备金属镁,其流程如下图所示(图中A、B、C均表示主要成分):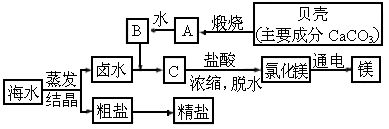
请填写下列空白:
(1)C
的化学式为_______.(2)
写出A→B的化学反应方程式_______.(3)
整个过程中没有涉及到的基本反应类型是_______.(4)
若在实验室进行粗盐提纯,溶解、过滤、蒸发(结晶)三步操作中都要用到的玻璃仪器是_______.查看答案和解析>>
科目:初中化学 来源:2010年专题训练:身边的化学物质1(解析版) 题型:解答题
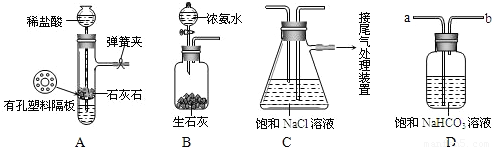
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com