
 ×100%,因此,需要由反应放出氧气质量计算分解的过氧化氢的质量;根据质量守恒定律,而反应前后烧杯内物质的总质量差即为氧气的质量;
×100%,因此,需要由反应放出氧气质量计算分解的过氧化氢的质量;根据质量守恒定律,而反应前后烧杯内物质的总质量差即为氧气的质量;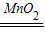 2H2O+O2↑
2H2O+O2↑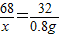 解得x=1.7g
解得x=1.7g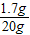 ×100%=8.5%
×100%=8.5%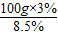 ≈35.3g
≈35.3g

 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源:2010年山西省中考化学试卷(解析版) 题型:解答题
| 实 验 步 骤 | 现 象 | 结 论 |
| 情况①正常 |
查看答案和解析>>
科目:初中化学 来源:2010年山西省中考化学试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com