
下表是NaCl、KNO3在不同温度时的溶解度: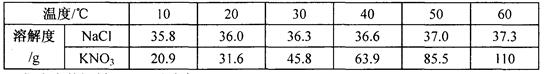
跟据表内数据判断,下列说法错误的是
| A.KNO3和NaCl的溶解度曲线在20℃~30℃相交 |
| B.60℃时,向105g KNO3的饱和溶液中加入95g水,所得溶液的溶质的质量分数为27.5% |
| C.从含有少量NaCl的KNO3饱和溶液中得到较多的KNO3晶体,通常采用冷却热饱和溶液的方法 |
| D.20℃时,NaCl和KNO3固体各35g分别加入两只各盛有100g水的烧杯中,充分搅拌后均能形成饱和溶液 |
D
解析试题分析:根据题意分析判断。
A、根据表格可知,KNO3和NaCl的溶解度在20℃~30℃温度范围内有相同的时候,所以两种物质的溶解度曲线在此范围内相交,正确;
B、60℃时KNO3的溶解度是110g,即每210g溶液中最多含有硝酸钾110g,则105g饱和溶液溶液含有硝酸钾55g,所以再加入95g水后,溶液中溶质的质量分数为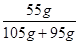 ×100%=27.5%,正确;
×100%=27.5%,正确;
C、根据图表可知:氯化钠的溶解度随温度的升高而逐渐增大,但受温度的变化影响较小;而硝酸钾的溶解度随温度的升高而逐渐增大,且变化较大;所以从含有少量氯化钠的硝酸钾饱和溶液中得到较多的硝酸钾晶体,可以采取冷却热饱和溶液的方法,正确;
D、在20℃时,NaCl的溶解度是36.0g,KNO3的溶解度是31.6g;所以20℃时分别将两种物质各35g加入两只各盛有100g水的烧杯中,可形成氯化钠的不饱和溶液,硝酸钾的饱和溶液,错误。故选D
考点:固体溶解度及其应用
点评:解答本题的关键是,要熟记和理解固体溶解度的概念及其应用,以及溶质质量分数的有关计算,只有这样才能正确作答。


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
下表是NaCl、KNO3在不同温度时的溶 解度:
解度:
| 温度/℃ | 10 | 20 |
| 40 | 50 | 60 | |
| 溶解度/g | NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
据此数据,判断下列说法错误的是( )
A.KNO3和NaCl的溶解度曲线在20℃-30℃温度范围内会相交
B.在60℃时,KNO3的饱和溶液105g加入95g水后,溶液中溶质的质量分数为27.5%
C.在20℃时,NaCl和KNO3固体各35g分别加入两只各盛有100g水的烧杯中,均不能形成饱和溶液
D.从含有少量NaCl的KN O3饱和溶液中得到较多的KN O3晶体,通常可采用冷却热饱和溶液的方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com