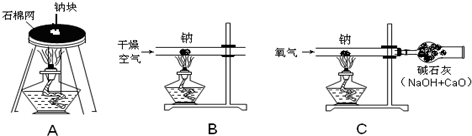
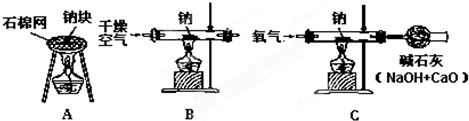
金属钠很软,可以用刀切割.切开外皮后,可以看到钠具有银白色的金属光泽.钠是热和电的良导体.钠的密度是0.97g/cm3,比水的密度小,钠的熔点是97.81℃,沸点是882.9℃.将金属钠放入水中,可以反应生成NaOH和H2;钠跟氧气混合加热生成淡黄色的过氧化钠(Na2O2)固体,钠跟CO2在加热条件下反应生成碳酸钠和单质碳.
(1)试写出钠跟水反应的化学方程式______.
(2)小刘同学用图A装置做钠跟氧气反应实验,观察到生成物中出现黑色固体,则该黑色固体是______(填化学式),试写出相应的化学反应方程式______ 2Na2CO3+C
【答案】
分析:1、根据信息书写化学方程式,关键找全反应物和生成物,并检查配平,本题关键是考查配平.
2、CO
2的来源分析是难点,要从反应的环境来全面分析.从整个反应环境来分析CO
2的来源有两个,一是来源空气中,但量比较少.二是酒精灯燃烧产生CO
2,产生的量要远大于空气中的量.
3、验证实验设计的关键要建立对比实验.本题主要是要验证空气中CO2是否参加反应,所以对比实验应该是“用纯氧代替空气做实验,然后对比结果”.
解答:解:(1)根据题干信息“钠放入水中,可以反应生成NaOH和H
2”书写方程式:2Na+2H
2O═2NaOH+H
2↑
(2)用图A装置做钠跟氧气反应实验,因为是在空气里进行的,可能发生两个反应:
①钠跟氧气混合加热生成淡黄色的过氧化钠(Na
2O
2)固体,2Na+O
2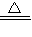
Na
2O
2 ②钠跟CO
2在加热条件下反应生成碳酸钠和单质碳,4Na+3CO
2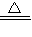
2Na
2CO
3+C.
综合以上分析黑色固体只可能是碳;
(3)从整个反应环境来分析CO
2的来源有两个,一是来源空气中,但量比较少.二是酒精灯燃烧产生CO
2,产生的量要远大于空气中的量.应该是主要来源.
所以可以猜想CO
2的来源①空气成分.②酒精燃烧,且②是CO
2的主要来源.
通过B装置反应后测出试管的质量、通过C装置反应后也测出试管的质量,对比两个数值可以证明空气中的CO
2是否参与反应,同时也就证明那个猜想正确.
所以用装置B和C主要目的是用来证明猜想或空气中CO
2是否参与反应.
故填:(1)2Na+2H
2O═2NaOH+H
2↑
(2)C;4Na+3CO
2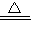
2Na
2CO
3+C
(3)①空气;②酒精燃烧; ②;验证空气中CO2是否参与反应(或验证猜想)
点评:本题是根据信息设计的一道综合性实验题,考查了学生整理信息及设计实验的能力.

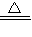 Na2O2
Na2O2 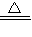 2Na2CO3+C.
2Na2CO3+C.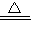 2Na2CO3+C
2Na2CO3+C