

| 稀盐酸的用量 | 第一次加入5g | 第二次加入5g | 第三次加入5g | 第四次加入5g |
| 剩余固体的质量 | 3g | 2g | l g | 1g |
 K2MnO4+MnO2+O2↑;A装置适宜涉及加热固体的反应,故可用于木炭还原氧化铜.
K2MnO4+MnO2+O2↑;A装置适宜涉及加热固体的反应,故可用于木炭还原氧化铜.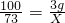 X=2.19g
X=2.19g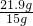 ×100%=14.6%
×100%=14.6% K2MnO4+MnO2+O2↑;③;(3)浓硫酸;b;量筒;
K2MnO4+MnO2+O2↑;③;(3)浓硫酸;b;量筒;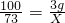 X=2.19g
X=2.19g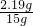 ×100%=14.6%
×100%=14.6%

 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案 互动课堂系列答案
互动课堂系列答案科目:初中化学 来源: 题型:
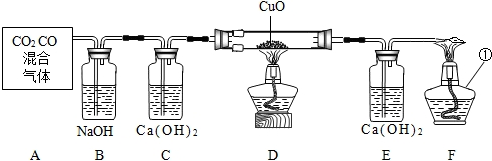
查看答案和解析>>
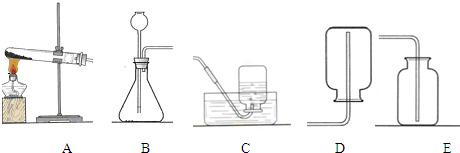
科目:初中化学 来源: 题型:阅读理解
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| MnO2粉末用量(g) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 |
| 所用时间(s) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 1 |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:

| ||
| △ |
| ||
| △ |
| ||
| ||
查看答案和解析>>
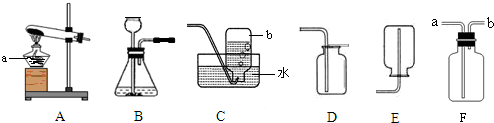
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com