解:(1)铁和氧气在点燃的条件下反应生成四氧化三铁,即反应物是铁和氧气,生成物是四氧化三铁,条件为点燃,根据质量守恒定律,反应前后原子的种类和数目不变,故方程式为3Fe+2O
2
Fe
3O
4.
(2)碳和氧化铜在高温下反应生成铜和二氧化碳气体,即反应物是碳和氧化铜,生成物是铜和二氧化碳,条件为高温,根据质量守恒定律,反应前后原子的种类和数目不变,故方程式为2CuO+C

2Cu+CO
2↑;该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应.
(3)碳酸钙在高温下分解生成氧化钙和二氧化碳,即反应物是碳酸钙,生成物是氧化钙和二氧化碳,条件下是高温,根据质量守恒定律,反应前后原子的种类和数目不变,故方程式为CaCO
3
CaO+CO
2↑;分解反应是由一种物质生成多种物质的反应,该反应符合定义.
(4)酒精与氧气在点燃的条件下反应生成二氧化碳和水,即反应物是酒精与氧气,生成物是水和二氧化碳,条件下是点燃,根据质量守恒定律,反应前后原子的种类和数目不变,故方程式为C
2H
5OH+3O
2
2CO
2+3H
2O.
(5)高锰酸钾在高温下分解生成锰酸钾、二氧化锰、氧气,即反应物是高锰酸钾,生成物是锰酸钾、二氧化锰、氧气,条件下是加热,根据质量守恒定律,反应前后原子的种类和数目不变,故方程式为2KMn
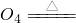
K
2MnO
4+MnO
2+O
2↑.
故答案为:(1)3Fe+2O
2
Fe
3O
4;
(2)2CuO+C

2Cu+CO
2↑(置换);
(3)CaCO
3
CaO+CO
2↑(分解);
(4)C
2H
5OH+3O
2
2CO
2+3H
2O;
(5)2KMn
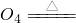
K
2MnO
4+MnO
2+O
2↑.
分析:(1)根据铁和氧气的性质及质量守恒定律书写.
(2)根据碳和氧化铜的性质及质量守恒定律书写方程式,根据置换反应的定义判断反应类型.
(3)根据碳酸钙的性质及质量守恒定律书写方程式,根据分解反应的定义判断反应类型.
(4)根据酒精的性质及质量守恒定律书写.
(5)根据高锰酸钾的性质及质量守恒定律书写.
点评:本题主要考查化学方程式的书写和反应类型,理解质量守恒定律的微观含义,掌握反应分类的有关概念和它们之间的联系,是解题的关键.

 Fe3O4.
Fe3O4. 2Cu+CO2↑;该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应.
2Cu+CO2↑;该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应. CaO+CO2↑;分解反应是由一种物质生成多种物质的反应,该反应符合定义.
CaO+CO2↑;分解反应是由一种物质生成多种物质的反应,该反应符合定义. 2CO2+3H2O.
2CO2+3H2O.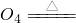 K2MnO4+MnO2+O2↑.
K2MnO4+MnO2+O2↑. Fe3O4;
Fe3O4; 2Cu+CO2↑(置换);
2Cu+CO2↑(置换); CaO+CO2↑(分解);
CaO+CO2↑(分解); 2CO2+3H2O;
2CO2+3H2O;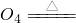 K2MnO4+MnO2+O2↑.
K2MnO4+MnO2+O2↑.