

| A. | 甲的金属活动性在甲乙丙丁中最强 | B. | 丙与稀盐酸或稀硫酸不反应 | ||
| C. | 乙应该是铁 | D. | 丁是一种廉价金属 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:选择题
| A. | 空气是混合物 | |
| B. | 空气中氧气的体积分数约为78% | |
| C. | 空气中含有水蒸气 | |
| D. | 氮气化学性质不活泼,可用于食品防腐 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量固体于试管中,加水振荡,直至完全溶解. | 无气泡产生 | 猜想 I不成立 |
| ②取少量①中的溶液于试管中,滴加CaCl2溶液. | 有白色沉淀产生 | 证明有Na2CO3存在 |
| ③ 取少量①中的溶液于试管中,加入过量CaCl2溶液使沉淀完全,静置后,向上层清液中滴加酚酞试液 | 酚酞试液变红 | 证明有NaOH存在 |
综合以上实验现象,说明猜想II是成立的. | ||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 |
假设正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 阴离子 阳离子 | 氢氧根离子 | 硝酸根离子 | 氯离子 | 硫酸根离子 | 碳酸根离子 |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 微 | 溶 | 溶 | 微 | 不 |
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 |
| Cu2+ | 不 | 溶 | 溶 | 溶 | 不 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
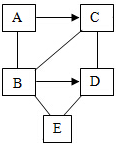 ABCDE是初中化学常见的不同类别的物质,其中A是铁锈的主要成分,D物质的溶液呈蓝色,C分别与B、D反应有一种产物相同,“→”表示一种物质转化为另一种物质,“--”表示两端物质一定条件下可以发生反应(反应条件、部分反应物和生成物略去),请回答下列问题:
ABCDE是初中化学常见的不同类别的物质,其中A是铁锈的主要成分,D物质的溶液呈蓝色,C分别与B、D反应有一种产物相同,“→”表示一种物质转化为另一种物质,“--”表示两端物质一定条件下可以发生反应(反应条件、部分反应物和生成物略去),请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com