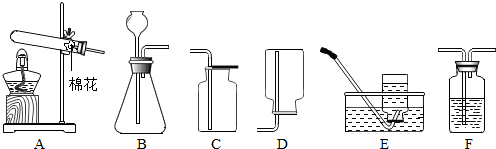
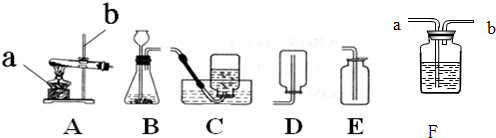
解:(1)铜绿受热分解产生氧化铜、水和二氧化碳,故反应的方程式为:Cu
2(OH)
2CO
3
2CuO+H
2O+CO
2↑;
故答案为:Cu
2(OH)
2CO
3
2CuO+H
2O+CO
2↑;
(2)C装置可用来测量生成的CO
2气体的体积,利用二氧化碳的气压增大把水压入量筒内,测得水的体积就是二氧化碳的体积,但由于二氧化碳易溶于水和水反应,故在水面上放一层植物油的目的是:防止二氧化碳和水反应,植物油上方原有的空气对实验的结果没有明显影响;
故答案为:防止二氧化碳和水反应;没有;
(3)利用B\C组合装置测得反应生成气体体积实际包括反应生成的气体,还有滴入锥形瓶内的液体的体积,所以,所测得结果偏大;故答案为:利用该装置测得气体体积,实际包括反应生成的气体,还有滴入锥形瓶内的液体的体积,所以,所测得结果偏大;
(4)过氧化氢溶液分解产生水和氧气,反应的方程式为:2H
2O
2
2H
2O+O
2↑;
故答案为:2H
2O
2
2H
2O+O
2↑;
(5):(1)由①②③对比可知加入二氧化锰、氧化铁后的反应速度明显提高,且由④可知其质量没有改变,故可说明它是这一反应的催化剂;
(2)②③是创设相同的条件只改变加入的物质进行对比实验,在过氧化氢溶液的溶质质量分数和体积都相同的条件下实验,才能比较出不加催化剂和加入二氧化锰或氧化铁后的催化作用;
(3)对比时间记录表中不同浓度的过氧化氢放出相同体积氧气所消耗时间,可发现H
2O
2浓度越大,产生氧气的速度越快;对比相同浓度的过氧化氢使不同催化剂时产生相同体积氧气所消耗时间,可发现MnO
2的催化效果比Fe
2O
3好;
故答案为:催化;5%;相同条件下,MnO
2的催化效果比Fe
2O
3好;在其他条件相同的情况下,H
2O
2浓度越大,产生氧气的速度越快.
(6)[实验验证]通过有无水泥块的实验对比,证明水泥块能否做催化剂,改变过氧化氢溶液分解的速率;
[讨论与反思]根据实验的步骤结合催化剂的定义,需要探究水泥块的质量和化学性质在反应前后是否发生改变;而测定反应前后的质量是否发生改变时需要通过过滤、洗涤、干燥等步骤完成分离;
故答案为:往盛有过氧化氢溶液的试管中,伸入带火星的木条;过氧化氢溶液在水泥块的作用下能够分解产生氧气;
水泥块的质量在反应前后是否改变;干燥;准确称量水泥块的质量;水泥块的化学性质是否改变.
分析:(1)根据铜绿受热分解产生氧化铜、水和二氧化碳书写化学方程式;
(2)根据二氧化碳易与水反应分析;明确测定二氧化碳的原理是利用气压增大把水压入量筒内来分析空气对实验结果的影响;
(3)分析量筒内所测的气体体积包括的成分分析误差;
(4)根据过氧化氢溶液分解产生水和氧气书写化学方程式;
(5)根据信息对比并结合催化剂的特征分析;从图表数据可以看出过氧化氢相同时,比较不同的催化剂,催化剂相同时可证明溶液浓度与反应速度的关系;
(6)根据催化剂的特征设计方案及操作步骤.
点评:本考点主要考查气体的制取和催化剂的探究等,综合性比较强.根据催化剂的特点:改变反应速度而自身的化学性质和质量不变,通过对比实验的现象和结果,得出两固体的催化作用;本考点是中考的重要考点之一,主要出现在实验题中.


 2CuO+H2O+CO2↑;
2CuO+H2O+CO2↑; 2CuO+H2O+CO2↑;
2CuO+H2O+CO2↑; 2H2O+O2↑;
2H2O+O2↑; 2H2O+O2↑;
2H2O+O2↑;

 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案