
 某校初三年级在实验室做二氧化碳制取实验,实验后的废液倒在废液缸中,化学课外活动小组欲对废液的酸碱性进行了探究.
某校初三年级在实验室做二氧化碳制取实验,实验后的废液倒在废液缸中,化学课外活动小组欲对废液的酸碱性进行了探究.
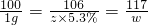
 ×100%≈4.0%
×100%≈4.0%

科目:初中化学 来源: 题型:
| 实验的步骤 | 实验现象 | 结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验的步骤 | 实验现象 | 结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验操作 | 现象 | 结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 某校初三年级在实验室做二氧化碳制取实验,实验后的废液倒在废液缸中,化学课外活动小组欲对废液的酸碱性进行了探究.
某校初三年级在实验室做二氧化碳制取实验,实验后的废液倒在废液缸中,化学课外活动小组欲对废液的酸碱性进行了探究.查看答案和解析>>
科目:初中化学 来源:2008年江西省南昌市中考化学模拟试卷(解析版) 题型:解答题
| 实验的步骤 | 实验现象 | 结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com