某同学欲配制质量分数为5%的盐酸溶液.现有一瓶未知深度的盐酸,为测定瓶内溶液中溶质的质量分数,取该溶液73g于烧杯中,加入15g石灰石(杂质不参与反应)恰好完全反应后,称得烧杯内剩余物质的总质量是83.6g,请根据要求回答下列问题:
(1)发生化学反应的化学方程式为______;
(2)生成气体的质量______;
(3)根据气体的质量列出求解盐酸中质质量(X)的比例式为______;
(4)瓶内盐酸溶液中溶质的质量分数是______;
(5)若取一定量的瓶内溶液配制溶质质量分数为5%的盐酸溶50g,需加入水的质量是______.
解:(1)稀盐酸和碳酸钙反应生成氯化钙、水、二氧化碳,反应化学方程式为:CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;
(2)生成气体的质量等于反应前物质的质量总和减去反应后烧杯内物质的质量总和:73g+15g-83.6g=4.4g;
(3)设氯化氢的质量为x,
CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑
73 44
x 4.4g
列比例式:
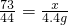
(4)由:
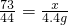
解得x=7.3g,
盐酸的溶质质量分数为:
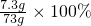
=10%
(5)要求加水的质量须先求需要原溶液的质量,设原溶液质量为m 则
50g×7%=m?10% 解得:m=35g 则加水的质量为50g-35g=15g,
故答为:(1)CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;(2)4.4g;(3)
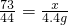
;(4)10%;(5)15g.
分析:(1)根据碳酸钙与盐酸的反应,写出反应的方程式;
(2)根据质量守恒定律,混合物减少的质量就是生成的二氧化碳的质量;
(3)根据碳酸钙与盐酸的反应的方程式,由生成的二氧化碳的质量,可列出盐酸中质质量(X)的比例式;
(4)根据上述式子可求出盐酸中质质量,再求出盐酸溶液中溶质的质量分数;
(5)根据溶质质量分数的计算公式可求出需加入水的质量.
点评:本题主要考查学生运用化学方程式和溶质质量分数和质量守恒定律综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

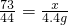
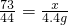 解得x=7.3g,
解得x=7.3g,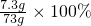 =10%
=10%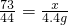 ;(4)10%;(5)15g.
;(4)10%;(5)15g.
