28、某兴趣小组为证明氢氧化钠溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验.
方案一:先用pH试纸测定氢氧化钠溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明氢氧化钠溶液与稀盐酸发生了化学反应.
(1)用pH试纸测定溶液的pH时,正确的操作是:
在白瓷板或玻璃片上放一小片pH试纸,将被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较
.
(2)简述强调“测得的pH小于7”的理由
排除因盐酸的加入,稀释氢氧化钠溶液而引起pH减小
.
方案二:先在氢氧化钠溶液中滴加几滴酚酞试液,溶液显红色,然后再滴加盐酸,可观察到红色逐渐消失,则证明氢氧化钠溶液与稀盐酸发生了化学反应.该组同学在向氢氧化钠溶液中滴加酚酞试液时,发现了一个意外现象:氢氧化钠溶液中滴入酚酞试液,溶液逐渐变成了红色,过了一会儿红色就消失了.该小组同学对这种意外现象的原因做了如下猜想:①可能是酚酞试液与空气中的氧气反应,使红色消失;②可能是酚酞试液与空气中的二氧化碳反应,使红色消失.
(1)为验证猜想①,该组同学做了如下实验:将配制的氢氧化钠溶液加热,并在液面上方滴一些植物油,然后在冷却后的溶液中滴人酚酞试液.实验中“加热”的目的是
赶走溶液中的少量氧气
,“滴入植物油”的目的是
隔绝氧气
.实验结果证明酚酞试液红色消失与空气中的氧气无关.
(2)为验证猜想②,该组同学做了如下实验:取一定量的碳酸钠溶液,在其中滴入酚酞试液,发现溶液也呈红色,由此可以得出以下两个结论:
结论1:说明
碳酸钠溶液呈碱性
;
结论2:说明酚酞试液红色消失与空气中的二氧化碳无关.
(3)该小组同学通过查阅资料得知:.当氢氧化钠溶液浓度很大时,就会出现上述意外现象.请设计实验证明该方案中取用的氢氧化钠溶液浓度过大:
①实验方法
取上述氢氧化钠溶液稀释后,做对比实验
;
②观察到的现象
加入酚酞试液出现红色且不褪去
.
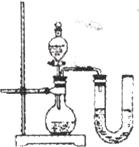
方案三:化学反应中通常伴随能量的变化,可借助反应前后温度的变化判断反应的发生.该组同学将不同浓度的盐酸和氢氧化钠溶液各10mL混合,用温度计测定室温下混合前后溶液温度的变化,并记录了每次混合前后温度的升高值△t(如下表).
| 编号 |
盐酸 |
NaOH溶液 |
△t/℃ |
| 1 |
3.65% |
2.00% |
3.5 |
| 2 |
3.65% |
4.00% |
X |
| 3 |
7.30% |
8.00% |
1 4 |
(1)表中X=
7
.
(2)某同学在没使用温度计的情况下,通过上图所示装置完成了实验.该同学根据
U型管中左边液面下降
判断氢氧化钠溶液与稀盐酸发生了中和反应.

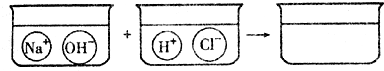 在氢氧化钠溶液中滴加稀盐酸没有观察到明显现象,根据要求回答下列问题:
在氢氧化钠溶液中滴加稀盐酸没有观察到明显现象,根据要求回答下列问题: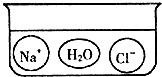 解:(1)由于氢氧化钠遇酚酞会变红,所以可在氢氧化钠溶液中滴入酚酞试剂,此时溶液变红,再加入稀盐酸,依据反应后红色消失判断氢氧化钠已经反应;该方法不是直接判断反应的进行而是借助指示剂的变色情况对反应是否发生进行的判断,是间接观察法;
解:(1)由于氢氧化钠遇酚酞会变红,所以可在氢氧化钠溶液中滴入酚酞试剂,此时溶液变红,再加入稀盐酸,依据反应后红色消失判断氢氧化钠已经反应;该方法不是直接判断反应的进行而是借助指示剂的变色情况对反应是否发生进行的判断,是间接观察法;


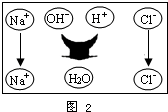

 该选用
该选用
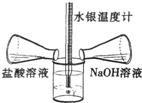

 某兴趣小组用如图所示装置做酸碱中和反应实验,试回答:
某兴趣小组用如图所示装置做酸碱中和反应实验,试回答: