
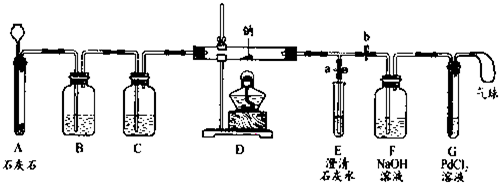
| 序号 | 实验操作 | 主要实验现象 | 实验结论和解释 |
| ① | 打开a,关闭b,由长颈漏斗注入稀盐酸 | A中产生大量气泡 E中出现浑浊 | E中反应的化学方程式为______ |
| ② | 当E中出现浑浊时,打开b,关闭a,点燃酒精灯 | D中Na剧烈燃烧,产生白烟内壁附着黑色、白色固体 G中产生黑色沉淀 | 反应产物一定有______和______ |
| ③ | 取D中白色固体于试管中,加水溶解,再加入石灰水 | 产生白色沉淀 | 反应产物还有______ |
 CaO+CO2↑
CaO+CO2↑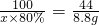


科目:初中化学 来源: 题型:阅读理解

| 序号 | 实验操作 | 主要实验现象 | 实验结论和解释 |
| ① | 打开a,关闭b,由长颈漏斗注入稀盐酸 | A中产生大量气泡 E中出现浑浊 |
E中反应的化学方程式为 Ca(OH)2+CO2═CaCO3↓+H2O |
| ② | 当E中出现浑浊时,打开b,关闭a,点燃酒精灯 | D中Na剧烈燃烧,产生白烟,内壁还附着黑色固体;G中产生黑色沉淀. | 产物中一定有: C 和CO |
| 实验操作 | 实验现象 | 结论 |
| ①取D中白色固体于试管中,加水溶解,振荡,再加入过量的氯化钙溶液. | 出现白色沉淀 | D中白色固体是 Na2CO3 ,而不是Na2O |
| ②静置片刻,取上层清液于试管中,滴加 无色酚酞溶液 |
无明显现象 |
查看答案和解析>>
科目:初中化学 来源: 题型:

| 序号 | 实验操作 | 主要实验现象 | 实验结论和解释 |
| ① | 打开a,关闭b,由长颈漏斗注入稀盐酸 | A中产生大量气泡 E中出现浑浊 |
E中反应的化学方程式为 CO2+Ca(OH)2=CaCO3↓+H2O |
| ② | 当E中出现浑浊时,打开b,关闭a,点燃酒精灯 | D中Na剧烈燃烧,产生白烟内壁附着黑色、白色固体 G中产生黑色沉淀 |
反应产物一定有 C 和CO |
| ③ | 取D中白色固体于试管中,加水溶解,再加入石灰水 | 产生白色沉淀 | 反应产物还有 Na2CO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| 序号 | 实验操作 | 主要实验现象 | 实验结论和解释 |
| ① | 打开a,关闭b,由长颈漏斗注入稀盐酸 | A中产生大量气泡 E中出现浑浊 |
E中反应的化学方程式为 CO2+Ca(OH)2=CaCO3↓+H2O CO2+Ca(OH)2=CaCO3↓+H2O |
| ② | 当E中出现浑浊时,打开b,关闭a,点燃酒精灯 | D中Na剧烈燃烧,产生白烟内壁附着黑色、白色固体 G中产生黑色沉淀 |
反应产物一定有 C C 和CO CO |
| ③ | 取D中白色固体于试管中,加水溶解,再加入石灰水 | 产生白色沉淀 | 反应产物还有 Na2CO3 Na2CO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 分别向右侧溶液中 加入无色酚酞溶液 |
CaCl2 | NaCl | Na2CO3 | NaOH |
| 主要实验现象 | 无色 | 无色 | 由无色变为红色 | 由无色变为红色 |
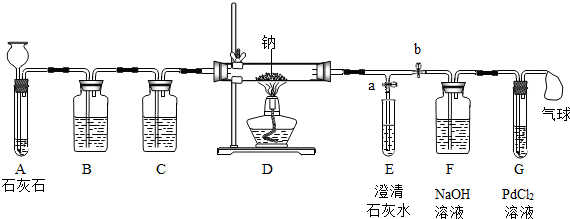
| 序号 | 实验操作 | 主要实验现象 | 实验结论及解释 |
| ① | 打开a,关闭b,由长颈漏斗注入稀盐酸 | A中产生大量气泡 E中出现浑浊 |
E中反应的化学方程式为 CO2+Ca(OH)2═CaCO3↓+H2O CO2+Ca(OH)2═CaCO3↓+H2O |
| ② | 当E中出现浑浊时,打开b,关闭a,点燃酒精灯 | D中Na剧烈燃烧,产生白烟 内壁附着黑色、白色固体 G中产生黑色沉淀 |
反应产物一定 有 C C 和CO CO |
| ③ | 取D中白色固体于试管中,加水溶解,再加入CaCl2溶液 | 产生白色沉淀 | 反应产物还有 Na2CO3 Na2CO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com