
 3Fe+4CO2
3Fe+4CO2 3Fe+4CO2.
3Fe+4CO2. 3Fe+4CO2.
3Fe+4CO2.

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:初中化学 来源: 题型:
| 操 作 | 现 象 | 结 论 |
方法一:把铝线、铁线、铜线同时插入盐酸中. 方法二:把铁线分别插入硫酸铝溶液和硫酸铜溶液中. |
铝表面产生的气泡比铁表面产生的气泡更多更快.铜线表面没有现象. 插入硫酸铝溶液中的铁线表面没现象,插入硫酸铜溶液中的铁表面出现红色的物质. |
三种金属活动性由强到弱的顺序是:Al、Fe、Cu |
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
| 金属种类 | 锰(Mn) | 镁 | 铁 |
| 与盐酸反应 | 略慢 | 快 | 很慢 |
| 等质量的金属(a克)与足量盐酸反应 | 镁 | 铁 | 锰 | ||||||
| 金属的相对原子质量 | 24 | 56 | 55 | ||||||
| 产生氢气的质量(g) |
|
|
| ||||||
| 找到的规律 | 相同质量的同价态的不同金属,与足量的酸反应,相对原子质量越大,生成氢气质量越小;反之亦然 相同质量的同价态的不同金属,与足量的酸反应,相对原子质量越大,生成氢气质量越小;反之亦然 | ||||||||
查看答案和解析>>
科目:初中化学 来源:2011-2012学年福建省福州市文博中学九年级第一学期期末复习试卷三 题型:探究题
(12分)同学们已经学习了有关金属的一些知识,对金属的活动性顺序也有了一定的认识。请运用所学知识参与以下探究并回答相关问题:
【实验一】将4枚洁净无锈的铁钉分别放入图12中 a、b、c、d 4支试管中。
上述实验中,____________试管中的铁钉最易生锈。设计如图d实验的目的是________
________________________________________。铁生锈的主要原因是铁与 、
等物质发生了复杂的化学反应。
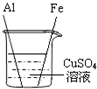
【实验二】为了探究Fe、Cu、Al三种金属的活动性顺序,小宁同学做了图13所示的实验.
(1)实验时,为了除去铝和铁表面的氧化物或污物,在插入溶液前应将 。
(2)实验时观察到的主要现象是 。得出的结论是______________________________。写出其中一种金属与硫酸铜溶液反应的化学方程式 。
(3)小成同学认为小宁同学设计的实验不能达到实验目的,原因是
,因此另设计一个实验,才能得出正确的结论。请你设计一个实验并完成下表:
| 操 作 | 现 象 | 结 论 |
| | | 三种金属活动性由强到弱的顺序是:Al 、Fe、Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com