
| 实验操作 | 实验现象 | 实验结论 |
| (1)取适量固体放于烧杯中,加足量蒸馏水溶解,静置后取上层清液,滴加无色酚酞溶液 | 固体溶解时烧杯外壁发烫 | 固体中一定含有①氧化钙 |
| 酚酞溶液变为②红色 | 固体中一定含有氢氧化钙 | |
| (2)另取少量固体放于试管中,滴加足量的盐酸 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液 | 固体中一定含有③铁,一定不含Fe2O3 |
| (3)将步骤(2)中产生的气体通入到澄清的石灰水中 | 澄清石灰水变浑浊 | 固体中一定含有④CaCO3 |
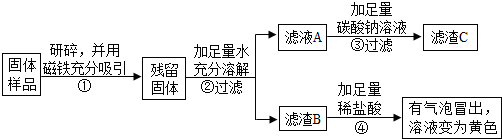
分析 【实验探究1】固体溶解时放出大量热,因为生石灰溶于水生成熟石灰放出大量的热,由此可以判断固体中一定含有氧化钙;但氧化钙与水反应生成的氢氧化钙也能使无色酚酞变红,不能确定原固体中是否含有氢氧化钙.取少量固体放于试管中,滴加足量的稀盐酸,固体逐渐消失,有大量无色气体产生,得到浅绿色溶液,固体中一定含有铁,不一定不含Fe2O3理由是:氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色.将生成的气体通入澄清石灰水,澄清石灰水变浑浊,说明固体中一定含有CaCO3;
【实验分析】(1)根据酚酞遇碱变红色,氧化钙和水反应生成氢氧化钙进行分析;
(2)根据氧化铁和盐酸反应生成的氯化铁也会与铁反应生成氯化亚铁进行分析;
【实验探究2】由乙丙同学的设计方案可知:磁铁吸引了铁粉,②中滤液A中的氢氧化钙和碳酸钠反应生成碳酸钙白色沉淀和氢氧化钠;取滤渣B于试管中,加入适量稀盐酸,有气泡冒出,溶液变为黄色,说明含有碳酸钙和氧化铁.仍有一种物质氢氧化钙不能确定,因此经过实验测得上述残留固体中含钙物质的总质量为1.6g,而滤渣B中CaCO3的质量为1.0g,故氧化钙或氢氧化钙或两者混合物质量为0.6g,与碳酸钠反应生成的滤渣C碳酸钙的质量为1.0g,C中钙元素质量是:1.0g×$\frac{40}{100}$×100%=0.4g,根据反应前后钙元素守恒,假设0.6g全是氧化钙,则含钙元素质量为0.6g×$\frac{40}{56}$×100%=0.428g,假设全是氢氧化钙,则钙元素质量为0.6×$\frac{40}{74}$×100%=0.324g,而C中钙元素质量为0.4g,因此是氧化钙和氢氧化钙的混合物,即久置固体的成分是:Fe、Fe2O3、CaO、Ca(OH)2、CaCO3;
【实验反思】根据紫色石蕊遇酸变红色进行分析.
解答 解:【实验探究1】甲同学的方案:
(1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液,固体溶解时试管外壁发烫,说明一定含有氧化钙,氧化钙溶于水放出大量的热,试管底部有不容物,溶液变红,不一定含有氢氧化钙,因为氧化钙和水反应生成氢氧化钙,也能使酚酞试液变红;
(2)另取少量固体放于试管中,滴加足量的稀盐酸,有大量无色气体产生,得到浅绿色溶液,固体中一定含有铁,不一定不含Fe2O3,因为氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色.
(3)将步骤(2)中产生的气体通入到澄清的石灰水中,石灰水变浑浊,说明固体中一定含有碳酸钙,碳酸钙与盐酸反应产生二氧化碳使石灰水变浑浊;
【实验分析】(1)酚酞遇碱变红色所以酚酞溶液颜色发生改变是因为溶液中含OH-离子,氧化钙和水反应生成氢氧化钙,化学方程式为:CaO+H2O=Ca(OH)2,该反应属于化合反应;
(2)氧化铁和盐酸反应生成的氯化铁也会与铁反应生成氯化亚铁,所以乙同学认为通过实验不能得出一定不含Fe2O3的结论,理由是:氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色;
【实验探究2】(1))④中发生的两个复分解反应是碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,氧化铁和盐酸反应生成氯化铁和水,化学方程式是:Na2CO3+2HCl=2NaCl+H2O+CO2↑,Fe2O3+6HCl=2FeCl3+3H2O;
(2)对滤渣B的探究:①取滤渣B于试管中,加入足量稀盐酸,有气泡冒出,溶液变为黄色,说明一定含有碳酸钙和氧化铁,碳酸钙与盐酸反应产生气泡,氧化铁与盐酸反应产生氯化铁溶于水呈黄色;
【实验结论】经过实验测得上述残留固体中含钙物质的总质量为1.6g,而滤渣B中CaCO3的质量为1.0g,故氧化钙或氢氧化钙或两者混合物质量为0.6g,与碳酸钠反应生成的滤渣C碳酸钙的质量为1.0g,C中钙元素质量是:1.0g×$\frac{40}{100}$×100%=0.4g,根据反应前后钙元素守恒,假设0.6g全是氧化钙,则含钙元素质量为0.6g×$\frac{40}{56}$×100%=0.428g,假设全是氢氧化钙,则钙元素质量为0.6×$\frac{40}{74}$×100%=0.324g,而C中钙元素质量为0.4g,因此是氧化钙和氢氧化钙的混合物,即久置固体的成分是:Fe、Fe2O3、CaO、Ca(OH)2、CaCO3,所以可判断实验小组同学们的猜想成立;
【实验反思】紫色石蕊遇酸变红色,所以探究硫酸和氢氧化钠反应后硫酸是否有剩余,还可选择一种试剂:紫色石蕊试液.
故答案为:【实验探究1】CaO,红,Fe,CaCO3;
| 实验操作 | 实验现象 | 实验结论 |
| (1)取适量固体放于烧杯中,加足量蒸馏水溶解,静置后取上层清液,滴加无色酚酞溶液 | 固体溶解时烧杯外壁发烫 | 固体中一定含有①氧化钙 |
| 酚酞溶液变为②红色 | 固体中一定含有氢氧化钙 | |
| (2)另取少量固体放于试管中,滴加足量的盐酸 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液 | 固体中一定含有③铁,一定不含Fe2O3 |
| (3)将步骤(2)中产生的气体通入到澄清的石灰水中 | 澄清石灰水变浑浊 | 固体中一定含有④碳酸钙 |
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | FeCl3、NaCl、KNO3 | B. | NaCl、NaOH、NaNO3 | ||
| C. | CaCl2、NaNO3、Na2CO3 | D. | KNO3、H2SO4、NaCl |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 原子、分子、离子都是构成物质的微粒 | |
| B. | 钠原子失去1个电子形成钠离子 | |
| C. | 氢分子、氢原子、氢离子统称氢元素 | |
| D. | 构成物质的微粒是在不停地运动 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 3:2:1 | B. | 12:10:22 | C. | 4:5:22 | D. | 5:4:22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com