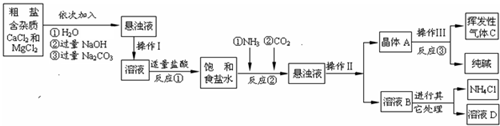
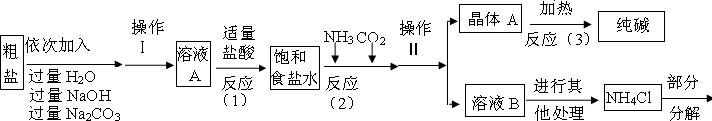
解:(1)①氯化钙能与碳酸钠反应生成碳酸钙沉淀和氯化钠,所以A中的溶质主要是氯化钠,由于氢氧化钠和碳酸钠过量,溶液A中也有氢氧化钠和碳酸钠;
故答案为:NaOH(氢氧化钠)、Na
2CO
3(碳酸钠);
②过滤是把固体与液体分开的操作,操作Ⅱ将混合物分成了晶体与溶液,正是通过过滤操作;
故答案为:过滤;
③粗盐中含有少量可溶性杂质(MgCl
2和CaCl
2),氯化镁能与氢氧化钠反应生成氢氧化镁沉淀和氯化钠,所以加入氢氧化钠溶液是除去粗盐中的氯化镁;
故答案为:MgCl
2(氯化镁);
④碳酸钠溶液与氯化钙溶液反应生成碳酸钙沉淀和氯化钠,方程式是CaCl
2+Na
2CO
3═CaCO
3↓+2NaCl;
故答案为:CaCl
2+Na
2CO
3═CaCO
3↓+2NaCl;
(2)根据生产流程中涉及的方程式和流程图,发现二氧化碳、氨气、氯化氢、碳酸钠为重复使用的物质;
故选ABC;
(3)①由题意知:晶体A充分受热,可分解制得纯碱及两种常见的氧化物;依据反应流程图可知A是碳酸氢钠,化学反应前后元素的种类不变,从而推测出碳酸氢钠分解生成碳酸钠、水和二氧化碳;
故答案为:2NaHCO
3
Na
2CO
3+H
2O+CO
2↑;
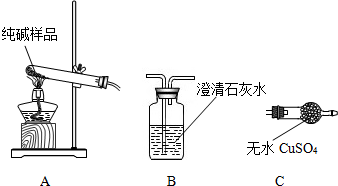
②碳酸钠化学性质稳定,碳酸氢钠受热易分解生成碳酸钠、水、二氧化碳;而二氧化碳能使澄清的石灰水变浑浊,无水硫酸铜遇水变蓝,可用来检验水,据此可设计实验;
故答案为:
| 选择的装置 | 实验现象 | 实验结论 |
| AB”或“AC”或“ACB | “B不变浑浊”或“C不变蓝”或“C不变蓝、B不变浑” | 样品不含晶体A |
(4)取纯碱样品加水溶解,向该溶液中加入过量稀HNO
3,反应掉碳酸钠,再滴加AgNO
3溶液,仍有白色沉淀,说明一定含有氯化钠,反应的方程式为AgNO
3+NaCl═AgCl↓+NaNO
3故答案为:AgNO
3+NaCl═AgCl↓+NaNO
3;
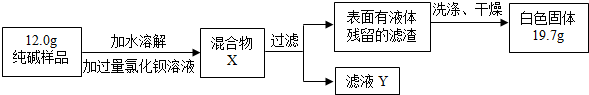
(5)①判断加入氯化钡溶液是否过量的合适方法是:静置混合物X,向上层清液中再滴少许氯化钡溶液,如有沉淀生成,说明氯化钡溶液不足;
故选A;
②判断滤渣是否洗涤干净,实际上是检验过量的氯化钡溶液是否洗净;氯化钡可与稀硫酸和碳酸钠溶液反应生成硫酸钡和碳酸钡沉淀,通过观察是否有沉淀生成可判断氯化钡溶液是否洗净;
故选BC;
③设样品中碳酸钠的质量是X
BaCl
2+Na
2CO
3═BaCO
3↓+2NaCl
106 197
X 19.7g
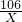
=
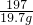
X=10.6g
所以样品中碳酸钠的质量分数是:
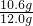
×100%=88.3%
答:样品中碳酸钠的质量分数是88.3%.
分析:(1)①根据氢氧化钠和碳酸钠都是过量,再结合生成物写出溶质的化学式;
②根据过滤是分离不溶于液体的固体和液体的方法考虑;
③根据氢氧化镁是沉淀考虑;
④根据碳酸钠溶液可与氯化钙溶液反应生成碳酸钙沉淀书写方程式;
(2)根据流程图,反应物与生成物中的共同物质考虑;
(3)①根据充分受热,碳酸氢钠即可分解制得纯碱及两种常见的氧化物来考虑生成物和反应物,进而写出方程式;
②根据碳酸氢钠受热易分解,碳酸钠受热不易分解,设计实验检验其产物;二氧化碳可用澄清的石灰水检验,无水硫酸铜遇水变蓝,可用来检验水;
(4)氯化钠与硝酸银反应可生成不溶于硝酸的氯化银沉淀;
(5)①根据氯化钡与碳酸钠反应可生成碳酸钡沉淀分析;
②判断滤渣是否洗涤干净,实际上是检验过量的氯化钡溶液是否洗净;然后根据氯化钡可与稀硫酸和碳酸钠溶液反应生成沉淀进行分析解答;
③根据白色固体是碳酸钡,据其质量结合方程式计算碳酸钠的质量,进而计算样品中碳酸钠的质量分数.
点评:本题充分考查利用课本知识解决新问题能力,能加深学生对课本知识的理解,训练学生的思维能力、分析解决问题的能力,难度稍大.

 NH3↑+HCl↑.
NH3↑+HCl↑.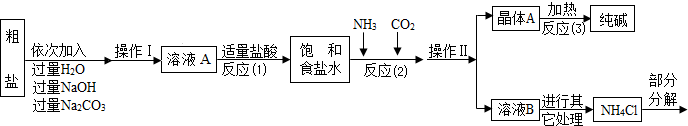
 Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;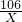 =
=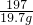
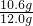 ×100%=88.3%
×100%=88.3%

 小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为
小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为