
【题目】化学是造福人类的科学。
(一)家庭中的化学知识
(1)市场上绿色碘盐、补铁酱油中的“碘”、“铁”指的是_________(选填序号)。
A.单质 B.元素 C.分子 D.原子
(2)“直饮水”机采用“活性炭+超滤层+煮沸”净水工艺,活性炭在此起________作用。
(3)多喝硬水易得白内障,硬水要通过________降低硬度后才能喝。
(4)含氟牙膏能有效预防龋齿。某氟(F)原子中质子数为9,中子数为10,则该氟原子的核外电子数为________。
(5)炒菜时,油锅起火了,可采取的灭火措施是_________。
(6)从微粒的角度分析,下列对生活中的事实解释错误的是_________(选填序号)。
选项 | 事实 | 解释 |
A | 食物变质 | 分子本身发生了变化 |
B | CO可燃而CO2不可燃 | 两种物质的分子构成不同 |
C | 温度计中的水银热胀冷缩 | 原子的大小发生改变 |
D | 湿衣服晾在太阳底下干得快 | 分子运动速率随温度升高而增大 |
(二)生活中的钙片选择
钙是维持人体正常功能所必需的元素。下图分别为两种补钙剂说明书的一部分。

(7)人体缺钙有可能导致_________(选填序号)。
A.骨质疏松症 B.贫血症 C.甲状腺肿大 D.发育停滞、智力低下
(8)每个葡萄糖酸钙分子中含有_______个原子。
(9)金钙尔奇钙片中碳酸钙的质量分数为_________。
(10)按照金钙尔奇说明书每日的补钙量,若改用葡萄糖酸钙(相对分子质量为430)片,一日3次,一次应服用________片。
(三)钙片中钙含量测定
某兴趣小组用右图实验探究该金钙尔奇钙片中含钙量是否达到了说明书中标明的含量。

(11)将小烧杯中稀盐酸(足量)分批加入大烧杯中,并不断搅拌,判断钙片中CaCO3完全反应的现象是_________。
(12)实验记录如下:
实验进程 | 起始(/g) | 最终(/g) |
电子天平读数 | 172.00 | 171.56 |
分析以上数据,最终生成CO2的质量是______g。
(13)每片该金钙尔奇钙片中含钙量_____(填“>”、“=”或“<”)说明书中标明的含量 (请根据反应前后碳元素的质量不变,先计算出CaCO3的质量,再计算Ca的质量)。
(14)该实验能否用普通的托盘天平来代替电子天平?请判断并说明理由___________。
【答案】 B 吸附 煮沸 9 盖上锅盖 C A 49 70% 4 不再冒气泡 0.44 < 不能,因为托盘天平只能精确到0.1g
【解析】(1) 绿色碘盐、补铁酱油中的“碘”、“铁”不是以单质、分子、原子等形式存在,这里所指的“碘、铁”是强调存在的元素;(2) 活性炭具有吸附性,能吸附异味和色素;(3) 加热煮沸可以除去水中的钙离子和镁离子,从而降低水的硬度;(4) 根据在原子中,原子序数=质子数=核电荷数=核外电子数,可知氟原子核外有9个电子;(5) 炒菜时,油锅起火了,可采取的灭火措施是盖上锅盖;(6)A、食物变质,发生了化学变化,分子的本身发生了改变,故A正确;B、CO可燃而CO2不可燃,是因为两种物质的分子结构不同,故B正确;C、水银温度计受热,水银柱上升,是因为汞原子之间的间隔变大,故C错误;D、湿衣服晾在太阳底下干得快,是因为温度升高,水分子运动速率加快,故D正确;(7) 儿童缺钙易患佝偻病,成年人或老年人缺钙易患骨质疏松症;(8) 由葡萄糖酸钙(C12H22O14Ca)的化学式可知,每个葡萄糖酸钙分子中含有:12+22+14+1=49个原子;(9) 金钙尔奇钙片中碳酸钙的质量=560mg![]() =1.4g,金钙尔奇钙片中碳酸钙的质量分数=
=1.4g,金钙尔奇钙片中碳酸钙的质量分数=![]() =70%; (10) 设需要一次应服用的片数为X,则
=70%; (10) 设需要一次应服用的片数为X,则![]() ,X =4;(11) CaCO3和盐酸反应放出二氧化碳气体,所以, CaCO3完全反应的实验现象是最后一次加入稀盐酸,不再有气泡冒出;(12)根据质量守恒定律可知,最终生成CO2的质量是:172.00g-171.56g=0.44g;(13)设该片中涵盖的质量为y,根据质量守恒定律可得:
,X =4;(11) CaCO3和盐酸反应放出二氧化碳气体,所以, CaCO3完全反应的实验现象是最后一次加入稀盐酸,不再有气泡冒出;(12)根据质量守恒定律可知,最终生成CO2的质量是:172.00g-171.56g=0.44g;(13)设该片中涵盖的质量为y,根据质量守恒定律可得:
CO2 ![]() CaCO3
CaCO3 ![]() Ca
Ca
44 40
0.44g y
![]()
y=0.4g,即400mg<560mg,
(14) 托盘天平只能精确到0.1g,不能满足实验要求。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】按下列要求完成化学方程式.
(1)硫在氧气中充分燃烧:_______________________________________;
(2)高温加热氧化铜(足量)和木炭的混合物:_____________________;
(3)用熟石灰中和废水中的硫酸:_________________________________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列有关催化剂的说法中错误的是
A. 催化剂就是二氧化锰
B. 催化剂能改变其他物质的化学反应速度
C. 在化学反应前后催化剂的质量没有改变
D. 在化学反应前后催化剂的化学性质没有改变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学用镁条测定空气中氧气含量,实验完毕,冷却后进入水的体积远大于总容积的1/5,且产生了淡黄色固体。某兴趣小组对此现象作如下探究。

【问题】为什么会生成淡黄色固体?为什么测得氧气的体积分数会明显偏大?
【资料】镁元素化合物的颜色:
物 质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
颜 色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
【猜想】(1)小组成员一致认为产物中一定不含有氯化镁,理由是__________;
(2)分析资料,小组成员认为淡黄色固体是Mg3N2,是由镁与空气中的______(填化学式)反应生成的,导致进入水的体积远大于总容积的1/5。
【实验】小组成员设计并进行了下列实验。
①组装仪器(如下图,钟罩下端无底)。
②将足量白磷在空气中点燃后,迅速伸入钟罩内,塞紧橡皮塞(图1);

③待钟罩内水面不再变化时,向水槽中加水,使水槽中液面与钟罩内液面相平;
④打开橡皮塞,将燃着的螺旋状镁条迅速伸入钟罩内,塞紧橡皮塞(图2);
⑤待钟罩内水面不再变化时,观察钟罩内壁及表面皿中出现淡黄色固体。
【分析】(3)请将步骤①补充完整____________。
(4)步骤②中将足量白磷在钟罩内燃烧的目的是_________;钟罩内水面的变化情况是___________。
(5)步骤③中加水的目的是为了防止__________。
【结论】小组同学的猜想正确。
【拓展】(6)通过以上探究,你对燃烧有什么新认识?请写一点_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】己知:A、D为白色固体,B、E为无色液体,C、E为无色气体,反应①②加入黑色粉末 M能大大加快反应速率,且M在反应前后质量和化学性质均不变。
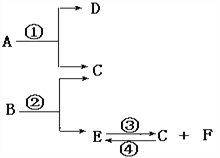
⑴完成①②③④四个反应的方程式
①__________________________②_______________________
③__________________________④________________________
⑵若要分离出反应②中的黑色粉末 M, 可采用的操作方法的名称是_______,该操作中所需的玻璃仪器是_______、________、________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校化学兴趣小组的同学利用下图所示装置,用高锰酸钾制取一瓶氧气

(1)做细铁丝燃烧实验. ⑵粗略测定加热 2g 高锰酸钾所收集到的氧气体积
(2)原理 (用方程式表示)高锰酸钾制氧气_____________________________
(3)写出仪器①②的名称:①__________②_____________
(4)问题分析:
①实验过程中发现 B 瓶中的水变红了 , 原因是________________
②用收集到的氧气做细铁丝燃烧实验时 , 发现瓶底炸裂 ? 发生失误的操作原因可能是_______
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】完成下列化学方程式:
(1)细铁丝在氧气中燃烧______;
(2)加热氯酸钾和二氧化锰的混合物______;
(3)氢氧化钙和盐酸反应______.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组通过实验探究分解氯酸钾制氧气的反应中二氧化锰的作用,该反应的化学方程式为______________________________。
【设计实验】用图1所示装置进行实验, 步骤如下:
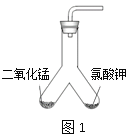
步骤Ⅰ:__________________;
步骤Ⅱ:装入药品;
步骤Ⅲ:加热右侧支管,用带火星的木条在导管口检验生成的气体;
步骤Ⅳ:冷却后,将装置倾斜,使左侧支管中的药品进入右侧支管,再加热右侧支管,用带火星的木条在导管口检验生成的气体。
【实验现象】步骤Ⅲ和步骤Ⅳ中,一段时间后都能观察到带火星的木条复燃,但不同的是_____________。
【交流反思】要想确认分解氯酸钾制氧气的反应中二氧化锰是催化剂,还需通过实验证明二氧化锰的______________和____________在反应前后都没有发生变化。
【拓展探究】在老师的指导下,该小组同学利用图2所示装置继续进行深入探究。以氧气的体积分数为纵坐标,温度为横坐标,得到图3 所示曲线(图中的“1︰2”、“1︰1”、“2︰1”、“3︰1”、“4︰1”、“5︰1”指氯酸钾和二氧化锰的质量比)。

【实验分析】根据图3,氯酸钾的分解温度随氯酸钾和二氧化锰的质量比变化的大致规律是__________________;分解氯酸钾制氧气的反应中二氧化锰起催化作用,可能是因为二氧化锰能_________________。
【交流应用】将29.4g氯酸钾和二氧化锰的混合物(氯酸钾和二氧化锰的质量比为5︰1)加热至完全反应,剩余固体的质量为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com