解:(1)可溶性的重金属盐,能电离出重金属离子,它能破坏蛋白质的结构,服用含有丰富蛋白质的食品,可防止人体本身的蛋白质被破坏,有解毒作用.
A、水中不含有蛋白质,所以错误.
B、肥皂水呈碱性,可用于酸性毒素的解毒,但不含蛋白质,所以错误.
C、蛋清的主要成分是蛋白质,所以正确.
D、盐水中主要含有氯化钠,不含蛋白质,所以错误.
故选C.
(2)医疗上用x射线检查肠胃病时,用的钡餐是硫酸钡,但不能是碳酸钡,因为胃酸中的盐酸可以和碳酸钡反应,BaCO
3+2HCl═BaCl
2+CO
2↑+H
2O,生成的氯化钡是可溶性重金属盐,可以使人中毒;
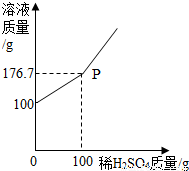
(3)①坐标的起点100g是氯化钡溶液的质量,随着稀硫酸的加入,产生硫酸钡的同时,溶液逐渐增加,等到完全反应时,由于没有沉淀的产生,所以溶液的质量的斜率变大;
②根据质量守恒定律:100g+100g-176.7g=23.3g是硫酸钡沉淀的质量;
③解:设BaCl
2质量为x
BaCl
2+H
2SO
4=BaSO
4↓+2HCl
208 233
x 23.3g

=
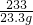
x=20.8g
原BaCl
2溶液的溶质质量分数为
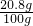
×100%=20.8%
答:原BaCl
2溶液的溶质质质量分数为20.8%.
故答案为:(1)C (2)没有自由移动的钡离子或BaSO
4不溶于胃酸
(3)①稀硫酸和氯化钡恰好完全反应 ②23.3
③解:设BaCl
2质量为x
BaCl
2+H
2SO
4=BaSO
4↓+2HCl
208 233
x 23.3g

=
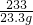
x=20.8g
原BaCl
2溶液的溶质质量分数为
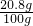
×100%=20.8%
答:原BaCl
2溶液的溶质质质量分数为20.8%.
分析:(1)根据重金属盐中毒的原理判断,即破坏人体的蛋白质结构,使之失去生理功能;
(2)根据碳酸钡和盐酸反应产生重金属离子钡离子对人有害的原理进行分析;
(3)①根据坐标的变化分析P点的意义;
②根据质量守恒定律及图信息示求出生成沉淀硫酸钡的质量;
③根据化学方程式,列出比例式求出氯化钡的质量,再根据溶质质量分数的公式计算溶质质量分数.
点评:本题主要考查重金属盐对人体的危害及有关的计算.在生产、生活中可能会遇到中毒现象或其它灾难,了解中毒原理、或事故发生原因,才会正确对事故进行处理,保障人的生命安全.

 (1)人误食重金属盐中毒后,为减轻毒性,最好服用下列物质中的______
(1)人误食重金属盐中毒后,为减轻毒性,最好服用下列物质中的______ =
=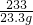
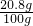 ×100%=20.8%
×100%=20.8% =
=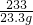
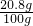 ×100%=20.8%
×100%=20.8%

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 (2013?海陵区二模)(1)人误食重金属盐中毒后,为减轻毒性,最好服用下列物质中的
(2013?海陵区二模)(1)人误食重金属盐中毒后,为减轻毒性,最好服用下列物质中的