
如图是KNO3和NaCl的溶解度曲线.据图回答:
(1)KNO3和NaCl两种饱和溶液的浓度相同时的温度是 ℃
(2)要从KNO3的溶液中析出晶体,通常采用的方法是 .
(3)在20℃时,某实验小组根据下表配制氯化钠溶液,计算并填写下表:
| 烧杯编号 | NaCl/g | H2O/g | 溶质的质量分数 |
| 1 | 10 | 90 | |
| 2 | 30 | 70 |
(4)若要得到溶质质量分数为20%以上的KNO3溶液,配制时的温度应不低于 ℃
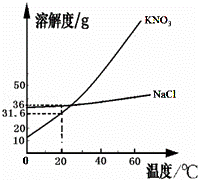
| (1)根据KNO3和NaCl的溶解度曲线的交点的意义分析; (2)根据KNO3的溶解度曲线随温度变化的情况分析结晶的方法; (3)根据在20℃时,NaCl的溶解度的溶解度进行计算; (4)根据KNO3的溶解度与饱和溶液中溶质的质量分数分析计算. | |||||||
| 解答: | 解:(1)由KNO3和NaCl的溶解度曲线可知,在22℃时,KNO3和NaCl的溶解度曲线交与一点,在此温度下,KNO3和NaCl的溶解度相同.两种饱和溶液的浓度相同; (2)由KNO3的溶解度曲线可知,KNO3的溶解度随温度的升高而明显增大.所以,从KNO3的溶液中析出晶体,通常采用的方法是加热浓缩后,再降温到室温; (3)由NaCl的溶解度曲线可知,在20℃时,NaCl的溶解度是36g,由溶解度的意义可知,在20℃时,在90g的水中能溶解NaCl的质量是32.4g>10g,在70g的水中能溶解NaCl的质量是25.2g<30g.所以: 烧杯1中溶质的质量分数是: 烧杯1中溶质的质量分数是: (4)设饱和KNO3的溶液溶质质量分数为20%时的KNO3的溶解度是x
由KNO3的溶解度曲线可知,在15℃时,KNO3的溶解度是25g.所以,若要得到溶质质量分数为20%以上的KNO3溶液,配制时的温度应不低于15℃. 故答为:(1)22℃;(2)加热浓缩后,再降温到室温.(3)见下表
(4)15. |


科目:初中化学 来源: 题型:
 (2013?番禺区一模)如图是KNO3和NaCl的溶解度曲线.据图回答:
(2013?番禺区一模)如图是KNO3和NaCl的溶解度曲线.据图回答:| 烧杯编号 | NaCl/g | H2O/g | 溶质的质量分数 |
| 1 | 10 | 90 | |
| 2 | 30 | 70 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com