
【题目】某化学兴趣小组为了测定当地的石灰石(主要成分是CaCO3 )的质量分数,他们取25克样品放入烧杯中,向其中逐渐加入100克一定质量分数的稀盐酸(杂质不溶于水也不与酸反应),所用稀盐酸的质量与剩余固体的质量关系如图所示,请根据图中的数据进行计算:
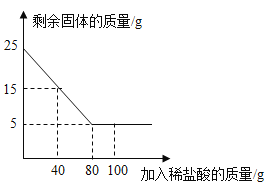
(1)当稀盐酸加到_____克时,样品与稀盐酸恰好完全反应。
(2)石灰石样品中CaCO3的质量分数为_____。(只填答案,不写计算过程)
(3)求恰好完全反应时所得溶液中溶质的质量分数。_____(要求计算步骤,精确到0.1%)
科目:初中化学 来源: 题型:
【题目】向Na2CO3溶液中加入一定量MgCl2溶液,出现白色沉淀。某同学经过过滤洗涤、低温烘干得白色固体,并进行如下探究:
(猜测)白色固体可能是:①MgCO3;②Mg(OH)2;③_____。
(资料)MgCO3、Mg(OH)2加热易分解,生成对应的两种氧化物。
(实验1)
(1)取适量白色固体,充分加热,将产生的气体通过装有无水硫酸铜的U形管,观察到现象为_____,则猜测①不成立。
(2)另取适量白色固体于试管中,加入_____,产生大量气泡,则猜测②不成立。有同学查阅资料得知上述固体应为碱式碳酸镁[aMgCO3·bMg(OH)2·3H2O],其不溶于水,加热易分解,工业上常用作阻燃剂。
(实验2)
(3)为进一步确定白色固体的组成,该同学取适量白色固体,充分加热至质量不再改变,并使产生的气体全部缓缓通过如图_____(选填“甲”或“乙”)装置,实验中浓硫酸的作用_____,浓NaOH溶液的作用_____。若错选为乙装置,则a:b的值会_____(填“变大”、“变小”或“不确定”)。根据实验测得的数据,经计算得知该碱式碳酸镁的化学式为[3MgCO3·Mg(OH)2·3H2O]。

(拓展延伸)
(4)将该碱式碳酸镁长期浸泡在浓NaOH溶液中,固体全部转化为Mg(OH)2,写出此反应的化学方程式_____。
(5)工业上用碱式碳酸镁作阻燃剂,其可能的原因有_____。
a.分解时吸热,降低可燃物的着火点
b.生成的固体覆盖燃烧物,隔绝氧气
c.生成的气体稀释了可燃物周围的氧气浓度
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室用海水晒盐后的卤水(含Mg2+等)制取氯化镁晶体(MgCl2 6H2O):

(1)为提高产率,试剂X应选用_____________(选填序号)。
a 饱和石灰水
b 石灰乳
(2)操作A中,所用玻璃仪器有_____________玻璃棒、烧杯。
(3)操作B为蒸发浓缩、______________、过滤、洗涤。
(4)操作B中洗涤时不可选用______________(选填序号)。
a 热水
b 冰水
c 饱和MgCl2溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了防上污染,用黄铜矿(主要皮分是CuFeS2及少量含Zn的化合物)炼铜时,将产生的废气、废液转换成工业原料,设计流程如下:

(1)已知步骤①为化合反应且反应前后各元素的化合价均不变,则X的化学式为_____。
(2)写出步骤②中反应的化学方程式_____。(任写一个)
(3)步骤③的操作是_____,固体B的化学式为_____。
(4)写出固体D的一种用途:_____,滤液a和b中相同溶质的名称为_____。
(5)若操作过程中物质的损失忽略不计,要生成2.8g B和3.2gD,则加入Zn的质量应大于_____g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】元素周期表是学习和研究化学的重要工具。下面是元素周期表的部分信息:
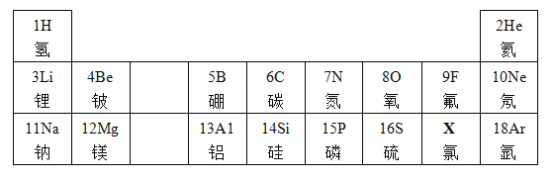
认真分析信息,回答:
(1)分析上表规律,可推知,表中X的元素符号是_____。
(2)通过上表查出地壳中含量最多的金属元素,其相对原子质量是_____。
(3)依据二、三周期的原子结构示意图,其排布规律是_____。
(4)写出一个由1、7、8号三种元素组成的物质的化学式_____ (只填一种)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列溶解度曲线和A物质的部分温度是的溶解度判断下列说法正确的是( )
温度/℃ | 0 | 20 | 40 | 60 | |
溶解度/g | A物质 | 20 | 28 | 45 | 60 |
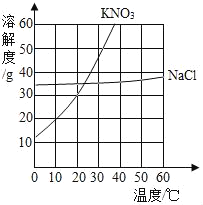
A. 由上图可知,KNO3和NaCl的溶解度均大于A 物质的溶解度
B. 10℃时,将40gNaCl放入50g水中,充分溶解,所得溶液是NaCl的不饱和溶液
C. 将30℃时NaCl、KNO3、和A物质的饱和溶液各降温至10℃,所得溶液的溶质质量分数大小为:KNO3>NaCl>A
D. 20℃时,将KNO3、NaCl和A物质各30g分别配制成恰好饱和溶液,所得溶液的质量大小为A>KNO3=NaCl
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据如图回答有关问题

(1)按一定标准将图一均分为两类,写出其中一个分类标准及包含微粒_____;
(2)图二,若A粒子带有两个单位的负电荷,则该粒子的符号为_____;由B可知,铝的相对原子质量为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业纯碱中常含有少量的氯化钠。某学习小组对其组成展开探究。现取24g纯碱样品,加入100g水使其完全溶解,再加入96g过量的氯化钙溶液.完全反应后,过滤洗涤、干燥得沉淀20g。完成下列问题:
(1)反应后溶液中含有的溶质是_____________(写 化学式);
(2)通过已知数据能求出的量有_____________( 写字母序号);
A反应后溶液的总质量
B参加反应的氯化钙的质量
C样品中碳酸钠的质量分数
D氯化钙溶液中溶质的质量分数
(3)计算纯碱样品中氯化钠的质量__________ (写出计算过程)。.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学们对一包干燥的红色粉末氧化铁的含量进行测定。请你参与并回答有关问题。称取该粉末5.0g装入硬质玻璃管中,按下图在通风橱中进行实验。开始时缓缓通入CO气体,过一段时间后再加热使其充分反应。待反应完全后,停止加热,继续通CO气体至玻璃管冷却。反应前后称量相关装置和物质的总质量,其数据如下表(假定粉末中的杂质不参加反应,也不发生变化):
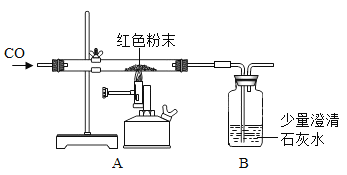
反应前 | 反应后 | |
①组 | 玻璃管和红色粉末的总质量为37.5g | 玻璃管和固体物质的总质量为36.3g |
②组 | 洗气瓶和所盛溶液的总质量为180.0g | 洗气瓶和瓶中物质的总质量为180.1g |
(交流讨论)
(1)开始实验时,在A装置中应_____(选序号“a.先通CO,排尽空气”“b.先加热红色粉末”)。
(2)选择①组的实验数据计算来确定红色粉末中氧化铁的质量分数是_____%,造成②组洗气瓶和瓶中物质的总质量增加量过小的原因是(写一点)_____。
(3)实验中观察到A装置反应管中的现象为_____。
(4)为了防止溶液倒吸,本实验停止加热前_____(填“需要”或“不需要”)先断开A和B的连接处。本实验中,为达到测定氧化铁含量的目的,可以用_____代替CO气体。
(反思评价)从环保角度看,该实验装置设计上不足之处是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com