
【题目】把A、B、C、D四种物质放在密闭容器中,在一定条件下充分反应,并测得反应物和产物在反应前后各物质的质量如表所示:
物质 | A | B | C | D |
反应前质量 |
|
|
|
|
反应后质量 | 待测 |
| 0 |
|
下列说法正确的是![]()
A. 物质C一定是反应物,物质D可能是单质
B. 反应后密闭容器中A的质量为![]()
C. 反应过程中,物质B和物质D变化的质量比为87:36
D. 若物质A与物质C的相对分子质量之比为194:216,则反应中A和C的化学计量数之比为2:1
科目:初中化学 来源: 题型:
【题目】已知A、B、C三种物质的溶解度曲线如图所示。
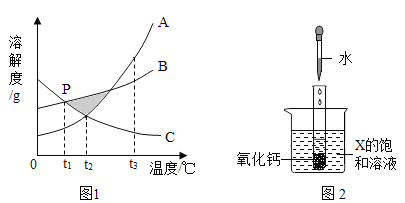
(1)t1℃时,A、B、C溶解度大小关系为______。
(2)若饱和B溶液中含有少量的C,提纯B的方法为______结晶,过滤。
(3)t2℃,将A、B、C的饱和溶液升温至t3℃,所得溶液溶质的质量分数大小关系为______。
(4)向试管中滴入2mL水后,若X中有固体析出,则X为______(选填“A、B、C”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组欲测定一瓶过氧化氢溶液![]() 过氧化氢和水的混合物
过氧化氢和水的混合物![]() 中过氧化氢的质量,实验操作及相关数据如图所示:
中过氧化氢的质量,实验操作及相关数据如图所示:
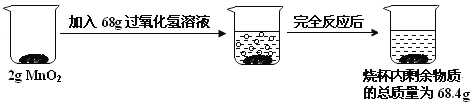
(1)生成氧气的质量______g,计算的依据是______
(2)这瓶过氧化氢溶液中过氧化氢的质量是_______?![]() 请根据方程式计算
请根据方程式计算![]()
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】对销售的KCl钾肥,国家有明确的质量要求,其中KCl的含量不低于83.4%。某兴趣小组对市售的某钾肥进行了检测,称取1.6g样品放入烧杯中,加入适量的水溶解后,逐滴加入5%AgNO3的溶液,产生沉淀的质量与所加入AgNO3溶液质量的关系如图1所示(假定杂质不参加反应)。
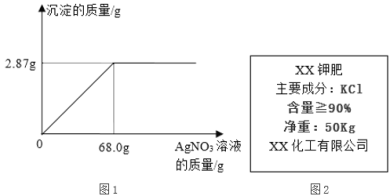
(1)68.0gAgNO3溶液中所含溶质的质量为_____g。
(3)通过计算,判断该钾肥中KCl的质量分数是否符合图2的包装说明?_____(写出计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属钛是重要的航天、航海材料,钛因其硬度大,熔点高,常温下不和非金属、强酸反应,被誉为“未来金属.”由钛铁矿(主要成分为钛酸亚铁,化学式为FeTiO3)、焦炭、氧气为原料,提取金属钛的主要工艺过程一般需要经过三个阶段:
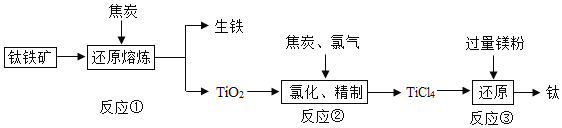
(1)反应前需要将钛酸亚铁和焦炭磨成粉末状的原因是______;钛酸亚铁(FeTiO3)中钛元素为______价.
(2)反应①中焦炭除了作还原剂还原金属矿物外,另一个重要作用是______.
(3)反应②中TiO2与C、Cl2在高温下反应,生成TiCl4和一种有毒气体,该气体是一种氧化物,其化学式为______.
(4)高温条件下,镁可以与TiCl4发生置换反应制得金属钛,请写出此反应的化学方程式______.
(5)如何从反应③后的固体中获得金属钛:______.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组对铜器表面生成的绿色铜锈展开如下探究,请回答有关问题.
(1)探究铜锈的组成.
(实验过程)
实验一:
实验步骤 | 实验现象 | 实验结论 |
a.取少量铜锈于试管中,加入适量稀硫酸 | 固体溶解,产生气泡,溶液呈_____色 | 铜锈中含有Cu2+ |
b.将生成气体通入___ | ___ | 铜锈中含有CO32﹣ |
实验二:另取少量铜锈隔绝空气加热,发现绿色粉末变黑色,试管壁上有水珠.
(实验结论)综合以上两实验,可以确认铜锈中含有_____种元素.
(2)探究铜生锈的条件.
(猜想)同学们对空气中有哪些物质参与了铜的生锈作出以下三种猜想:①CO2、H2O ②O2、H2O ③CO2、H2O、O2
根据铜锈的组成元素并结合铁生锈的知识,你认为上述猜想错误的是_____(填序号).
(实验设计)为验证另外两种猜想,同学们设计了下图中A、B两个对比实验,请你在方框内完成实验B的设计.(语言叙述或画图说明均可)_____.
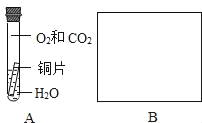
(预计结论)若A中的铜生锈,B中的铜不生锈,则正确的猜想是_____(填序号).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某课外兴趣小组为探究“蜡烛燃烧产物中含有哪些成分”,于是进行如下实验。
(查阅文献)蜡烛的主要成分是石蜡,石蜡是由碳、氢元素组成。
(猜想与假设)蜡烛燃烧的产物是二氧化碳和水。
(设计实验)
(1)将内壁涂有澄清石灰水的小烧杯罩在蜡烛火焰上方,发现烧杯内壁出现浑浊现象,证明有二氧化碳生成,其反应的化学方程式为_____。
(2)另取一只冷而干燥的小烧杯罩在蜡烛火焰上方,观察到_____,证明有水生成。在实验中,小华观察到一个异常现象:小烧杯内壁上产生少量黑色物质。
(交流与讨论)同学们一致认为该黑色物质可能是石蜡不完全燃烧生成的_____,理由是_____,据此,他们猜想还可能产生一氧化碳。
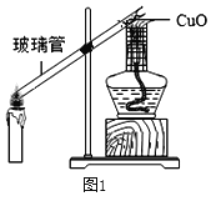
为验证存在该气体,小组成员设计图1所示的实验。
(设计实验)
(1)将玻璃管一段伸入蜡烛的焰心部分。
(2)用带有金属网罩的酒精灯加热另一端的氧化铜,一段时间后,观察到氧化铜由黑变红,证明蜡烛不充分燃烧有一氧化碳生成。对此,小明提出质疑:由以上现象不一定是生成了一氧化碳导致,还可能是_____。
同学们又在玻璃管中部放入_____重新实验,观察到黑色的氧化铜再次变红,由此确定蜡烛不充分燃烧有一氧化碳生成。
该兴趣小组欲利用数字化实验测定蜡烛发生不完全燃烧的产物,特设计如图2装置:收集含氧气50%的气体于钟罩内,将蜡烛点燃后放入钟罩,塞紧带有传感器的橡胶塞。实验过程中记录的相关数据如图3所示。请回答下列问题:
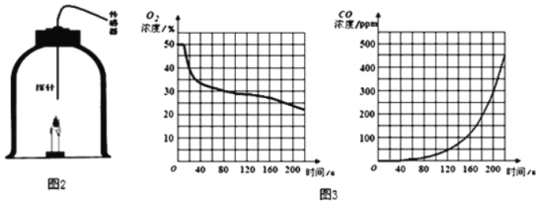
(1)在0~10s时,氧气浓度无明显变化的原因是_____。
(2)根据图象预测,蜡烛发生完全燃烧的时段为_____,结合图象说明理由_____。
(3)结合本实验记录的数据,写一条你的新认识_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。同学们对废旧手机中的金属回收产生兴趣。
(提出问题)
从废旧手机中可以回收到哪些有价值的金属?如何回收?

(查阅资料)
Ⅰ.手机电路板中的金属及其价格如下表所示:
种类 | Fe | Cu | Al | Ni | Au | Ag | Pd(钯) |
市场价格/($/t) | 365 | 7175.5 | 1710.5 | 14235 | 4.7×107 | 7.6×105 | 2.7×107 |
矿石中含量 | 72.4 | 0.87 | 29.1 | 1.02 | 4 | 120 | 0.4 |
手机电路板中含量 | 5 | 13 | 1 | 0.1 | 350 | 1380 | 210 |
说明:Fe、Cu、Al、Ni的含量用质量分数(%)表示,Au、Ag、Pd的含量的单位为“g/t”。
Ⅱ.Ni的金属活动性位于氢前;Pd的金属活动性位于氢后;NiCl2溶液为绿色。
(实验方案)

第一步:选择值得回收的金属。
依据资料Ⅰ中的数据,废旧手机中有回收价值的金属有Au、Ag、Cu、Pd,
(1)原因是:①它们的市场价格较高;②_____。
第二步:设计实验分离、回收部分金属。
序号 | 实验步骤 | 实验现象 |
Ⅰ | 取一废旧手机电路板,用电吹风机靠近电路焊接点的焊锡吹热风,一段时间后,用镊子将金属电路从塑料板中拽出 | 焊锡熔化 |
Ⅱ | 将金属电路放入烧杯中,加入过量10%的稀盐酸浸泡 | …… |
Ⅲ | 取Ⅱ中未溶解的金属电路,用蒸馏水洗净后,放入如上图所示装置中,进行实验。 | 溶液逐渐变成蓝色,仍有微量金属固体未溶解 |
Ⅳ | 过滤Ⅲ中烧杯中的物质,洗涤滤纸上的物质 | 滤纸上仍有微量金属固体 |
(问题讨论)
(2)由步骤I中的现象,可推知的焊锡的物理性质是_____(填字母)。
a.熔点低 b.硬度大 c.抗腐蚀性强
(3)步骤Ⅱ中实验室用溶质质量分数为37%、密度是1.18gmL-1的浓盐酸配制10%的盐酸185g,需要浓盐酸_____ml;配制该稀盐酸应选择的量筒量程(水的密度为1g/cm3)为_____(填字母)。
a.10ml b.50ml c.100ml d.200ml
(4)步骤Ⅱ所得溶液中,至少含有_____(填数字)种溶质,该步骤中对应的实验现象是_____。
(5)请写出步骤Ⅲ中,溶液变成蓝色的化学方程式_____。
(6)步骤Ⅳ中过滤操作用到的玻璃仪器有玻璃棒、_____和_____,其中玻璃棒的作用是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室有一包固体物质,可能含有氯化钠、硫酸钠、碳酸钾、硝酸钠和高锰酸钾中的一种或几种。为了确定该固体的成分,某化学小组的同学按下列框图进行实验。回答下列问题:

(1)该固体中一定没有___(写化学式)。
(2)根据实验现象分析,第①步所得无色溶液的pH____7(填“>”、“=”或“<”)。
(3)为了不干扰对第③和④步实验结论的判断,试剂A应选择____(写试剂名称)。
(4)第③步发生的化学反应方程式为___。
(5)最后滤液中的溶质有___种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com