
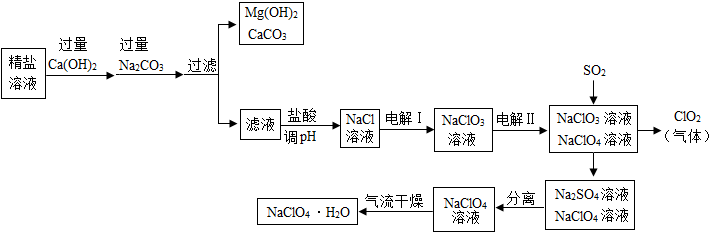
分析 (1)向精盐水中加入过量氢氧化钙时,氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,向精盐水中加入过量碳酸钠时,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠;
盐酸调节pH时,稀盐酸和氢氧化钠反应生成氯化钠和水,和碳酸钠反应生成氯化钠、水和二氧化碳;
(2)单质中元素化合价规定为零,化合物中元素化合价代数和为零;
(3)二氧化硫能和氯酸钠反应生成二氧化氯和硫酸钠;
(4)高氯酸钠在较高温度下容易分解,因此“气流干燥”时温度不宜过高.
解答 解:(1)向精盐水中加入过量氢氧化钙时,氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,向精盐水中加入过量碳酸钠时,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,因此滤液中溶质除NaCl外还含有氢氧化钠和碳酸钠;
盐酸调节pH时,稀盐酸和氢氧化钠反应生成氯化钠和水,和碳酸钠反应生成氯化钠、水和二氧化碳,反应的化学方程式为:NaOH+HCl═NaCl+H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑.
故填:氢氧化钠和碳酸钠;NaOH+HCl═NaCl+H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑.
(2)设ClO2中氯元素的化合价为x,
二氧化氯中氧元素化合价是-2,根据题意有:x+(-2)×2=0,
x=+4,
故填:+4.
(3)通入SO2是为了除去NaClO4溶液中少量的NaClO3,这是因为二氧化硫能和氯酸钠反应生成二氧化氯和硫酸钠,该反应的化学方程式为:SO2+2NaClO3=2ClO2+Na2SO4.
故填:SO2+2NaClO3=2ClO2+Na2SO4.
(4)“气流干燥”时温度应控制在75~95℃之间,其原因是防止温度过高时高氯酸钠分解.
故填:防止温度过高时高氯酸钠分解.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


 阶梯计算系列答案
阶梯计算系列答案科目:初中化学 来源: 题型:选择题
| A. | 2个铝离子:2Al3+ | B. | 钠原子的结构示意图: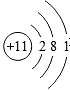 | ||
| C. | 氧分子:O | D. | 氧化镁中镁元素显+2价:$\stackrel{+2}{Mg}$O |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 整个过程中,硝酸钾溶液的质量分数不断增大 | |
| B. | 整个过程中,硝酸钾的溶解度不断增大 | |
| C. | 整个过程中,始终不断有硝酸钾晶体析出 | |
| D. | 析出晶体后,温度不变,加热相同时间析出的晶体质量相同 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 玻璃管质量m0/g | 玻璃管与钙的质量m1/g | 玻璃管与产物的质量m2/g |
| 14.80 | 15.08 | 15.25 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 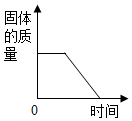 图表示煅烧石灰石 | B. | 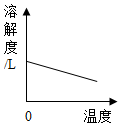 图表示CO2在水中的溶解性 | ||
| C. | 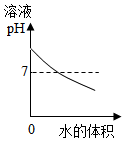 图表示向NaOH溶液中加水 | D. | 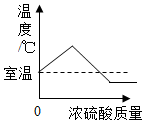 图表示将浓硫酸加入水中 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 向K2CO3溶液中滴入Ba(OH)2溶液至恰好完全反应.
向K2CO3溶液中滴入Ba(OH)2溶液至恰好完全反应. K+
K+ CO32-
CO32- OH-
OH-查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com