【答案】
分析:根据溶解度曲线,可以比较某一温度下物质的溶解度大小;可以查找物质的溶解度,根据所给物质的质量和溶解度的含义确定溶液的状态;判断物质的溶解度随温度变化的变化情况,从而确定饱和溶液降温后溶质的质量分数变化情况.
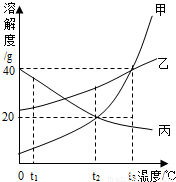
解答:解:(1)根据溶解度曲线可知:t
1℃时,甲的溶解度<丙的溶解度;
故答案为:<;
(2)t
2℃时,甲的溶解度是20g,即该温度下100g水最多溶解20g甲,所以将100g水加入到盛有15g甲物质的烧杯中,充分溶解后所得溶液是甲物质的不饱和溶液;
故答案为:不饱和;
(3)由于乙的饱和溶液的质量不确定,所以其饱和溶液中溶质的质量也不确定,故错误;
故答案为:错误;
(4)观察图表可知,甲、乙的溶解度随温度的降低而逐渐降低,丙的溶解度随温度的降低而逐渐增大;t
3℃时,将甲、乙、丙三种物质的饱和溶液同时降温到t
1℃,甲、乙均有溶质析出,甲析出的溶质最多,乙其次,而丙由于溶解度增大而无晶体析出.而降低到t
1℃时,由于溶解度是乙>甲,此时虽然丙的溶解度大,但由于不是饱和溶液,所以其溶解的物质还是和先前的t
3℃相同;此时计算还要考虑该温度下的溶解度,所以在t
1℃,溶解物质的关系就是甲<丙<乙,根据饱和溶液溶质质量分数的计算式

×100%,即溶解度越大质量分数也就越大,所以此时溶液的质量分数关系是甲<丙<乙;
故答案为:甲<丙<乙;
(5)t
3℃时甲的溶解度大于丙的溶解度,所以可分别取两个等大的烧杯,倒入等量的t
3℃的水,配成饱和溶液,则溶解较多的是甲,较少的是丙;
故答案为:能.
点评:本题主要考查了固体溶解度曲线所表示的意义,以及对固体溶解度概念的理解和应用,培养学生应用知识解决问题的能力.

 ×100%,即溶解度越大质量分数也就越大,所以此时溶液的质量分数关系是甲<丙<乙;
×100%,即溶解度越大质量分数也就越大,所以此时溶液的质量分数关系是甲<丙<乙;

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案