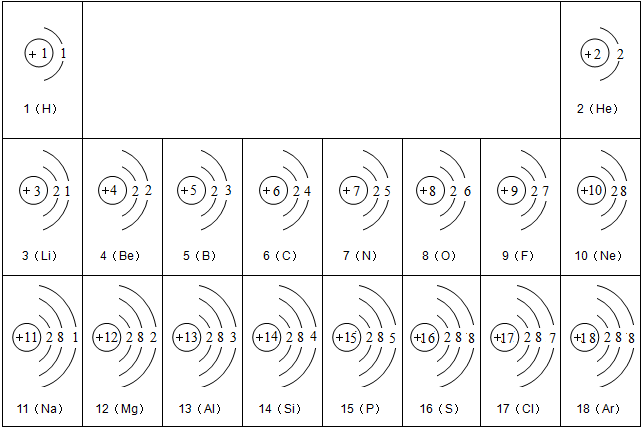
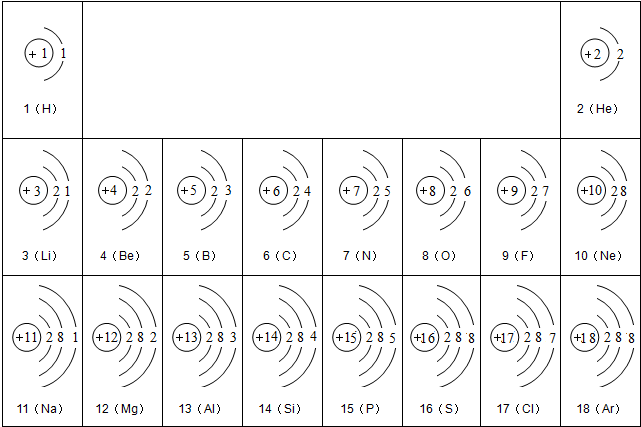
解:(1)由元素周期表及原子结构示意图可知,9号元素F最外层电子数为7,符合非金属原子的最外层电子数特点,故9号元素F属于非金属元素;根据最外层电子数,可知得1个电子达稳定,也就可知带1个负电荷数,故可书写离子符号为F
-;
(2)12号元素与17号元素分别为镁元素和氯元素,已知镁元素的化合价为+2价,氯元素与金属形成化合物时,其化合价为-1价,则标注化合价
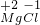
;利用化合价数值交叉法书写化学式,故其化学式为MgCl
2;
(3)归纳总结图表中的规律:通过分析,同一横行元素之间的排列有一定的规律,①从左到右,由金属元素逐渐向非金属元素过渡;②从左到右,各元素原子的电子层数相同;③从左到右,元素原子的最外层电子数依次增加或从左到右,元素原子的原子序数依次增加…
通过分析,同一竖列元素之间的排列也有一定的规律:电子层数逐渐增加;电子数之间的差为8…(只要合理均给分)(任写一条)
故答为:(1)非金属;
(2)F
-;
(3)通过分析,同一横行元素之间的排列有一定的规律,①从左到右,由金属元素逐渐向非金属元素过渡;②从左到右,各元素原子的电子层数相同;③从左到右,元素原子的最外层电子数依次增加或从左到右,元素原子的原子序数依次增加…(只要合理均给分)(任写一条)
分析:(1)由元素周期表及原子结构示意图可知,9号元素F最外层电子数,符合非金属原子的最外层电子数特点;根据最外层电子数,可知得电子情况,也就可知带电荷数,可书写离子符号;
(2)先推测12号元素与17号元素分别为镁元素和氯元素,再根据它们的化合价数值,利用化合价数值交叉法书写化学式;
(3)利用归纳总结的方法,归纳总结图表中的规律:同族(从上向下)的电子数、最外层电子数、电子层的关系;同一周期(从左到右)电子数、最外层电子数、电子层的关系.
点评:了解元素周期表的特点及其应用;了解元素的简单分类;掌握物质化学式的书写方法及意义.

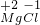 ;利用化合价数值交叉法书写化学式,故其化学式为MgCl2;
;利用化合价数值交叉法书写化学式,故其化学式为MgCl2;